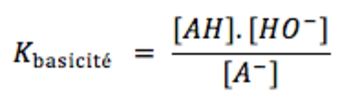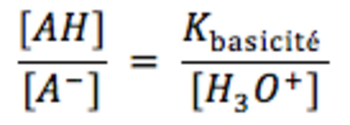-
Introduction à la Chimie organique<o:p></o:p>
<o:p> </o:p>
Nomenclature<o:p></o:p>
<o:p> </o:p>
Formule brute è C..H.. Ordre alphabétique<o:p></o:p>
Formule semi-développé è on enleve les liaisons CH, OH, NH2<o:p></o:p>
Formule développée è Lewis (doublets liants, non liants, charge, case vacantes)<o:p></o:p>
Formule topologique è trait + fonctions<o:p></o:p>
<o:p> </o:p>
Deux types de noms : <o:p></o:p>
- noms triviaux (traditionnels) : à utiliser si reconnu<o:p></o:p>
- nomenclature systématique (IUPAC)<o:p></o:p>
<o:p> </o:p>
IUPAC :<o:p></o:p>
- identifier la (les) fonctions<o:p></o:p>
- identifier la fonction principale (la prioritaire) et les fonctions secondaires (substituants ou hydrure parent)<o:p></o:p>
- mettre fonction principale en suffixe et fonctions secondaire en préfixe<o:p></o:p>
/ !\ halogénes jamais en suffixe<o:p></o:p>
- identifier la chaine carbonnée la plus insaturée et la plus longue et la plus substituée (hydrure parent)<o:p></o:p>
- placer les insaturations <o:p></o:p>
/ !\ lettre chiffre è un tiret <o:p></o:p>
/ !\ chiffre chiffre è virgule<o:p></o:p>
- placer les substituants (remplacé ane par yl) par ordre alphabétique <o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Polarisation des liaisons<o:p></o:p>
Électronégativité χ : capacité des éléments à attirer les électrons à lui <o:p></o:p>
On marque ainsi les charges partielles du à une polarisation de liaison δ<o:p></o:p>
On crée alors un moment dipolaire μ permanent<o:p></o:p>
μ = δ * d<o:p></o:p>
Quand le pourcentage ionique est très élevé (≈1) alors la liaison va être cassés et on aura une charge formelle è composé ionique<o:p></o:p>
Dans le tableau périodique plus on va vers le haut et vers la droite plus les éléments seront électronégatif.<o:p></o:p>
<o:p> </o:p>
L’effet inductif : lié à l’électronégativité, répartition des charges è donneur +I ou accepteur -I<o:p></o:p>
<o:p> </o:p>
L’effet mésomère : délocalisation des électrons, système conjugué (π – σ – π)[hétéroatome prend les électrons]<o:p></o:p>
è donneur +M ou accepteur -M<o:p></o:p>
<o:p> </o:p>
L’effet mésomère l’emporte sur l’effet inductif (sauf pour les dérivés halogénés) <o:p></o:p>
<o:p> </o:p>
Les carbocations sont des intermédiaires très réactionnels<o:p></o:p>
Quand la règle de l’octet est vraie è forme très staibilisante<o:p></o:p>
Benzylique > alhylique<o:p></o:p>
<o:p> </o:p>
Les interactions non covalentes.<o:p></o:p>
Les interactions électrostatiques : charge + avec – (550 kJ/mol dans le vide)<o:p></o:p>
Dans l’eau l’énergie de stabilisation est très faible <o:p></o:p>
Les interactions d’induction (Van der Waals) : moment dipolaire crée lors du déplacement des molécules. è hydrophobes<o:p></o:p>
Plus un atome est volumineux plus ils seront polarisables.<o:p></o:p>
Les liaisons d’hydrogène : hétéroatome chargé δ- lié H et un autre hétéroatome δ- avec un doublet non liantsè omniprésente dans les molécules biologiques (50kJ/mol).<o:p></o:p>
<o:p> </o:p>
Interactions avec le solvant : <o:p></o:p>
Trois catégories :<o:p></o:p>
- les solvants protiques : donneurs et accepteurs de liaisons hydogène (H20, acide acétique …)<o:p></o:p>
- les solvants polaires aprotiques (tétrahydrofurane, acétone, acétate d’éthyle, chloroforme, dichlorométhane, diméthylformamide, diméthylsulfoxyde) : juste accpeteur<o:p></o:p>
- les solvants apolaires : pas de moments dipolaires permanents (benzène, cyclohexane, toluène) <o:p></o:p>
<o:p> </o:p>
Le choix du solvant est fait par la miscibilité<o:p></o:p>
<o:p> </o:p>
L’eau aura une dissolution très forte :<o:p></o:p>
- Dissociation è dissocie <o:p></o:p>
- Solvatation è plus l’ion est chargé et petit plus il sera solvaté fortement<o:p></o:p>
<o:p> </o:p>
Isomérie :<o:p></o:p>
- Isomérie de constitution : même formule brute, pas même formule développé<o:p></o:p>
- isomérie de fonctions : fonciton pas au même endroit<o:p></o:p>
- isomérie de chaine : pas même longueur de chaine<o:p></o:p>
- isomérie de fonction : pas même fonction<o:p></o:p>
<o:p> </o:p>
Stéréo-isomérie : même formule dvpé, mais pas même disposition dans espace<o:p></o:p>
- conformation : même molécule, juste des rotations<o:p></o:p>
- configuration : molécule différente, cassé des liaisons<o:p></o:p>
<o:p> </o:p>
Représentation spatiale :<o:p></o:p>
Représentation de cram<o:p></o:p>
Projection de newman<o:p></o:p>
 votre commentaire
votre commentaire
-
Les couples acides bases<o:p></o:p>
<o:p> </o:p>
I) Définition <o:p></o:p>
Acide : molécule qui cède une ou x protons H+<o:p></o:p>
Monoacide (perd un proton) : NH4+ / H2O<o:p></o:p>
Polyacide (perd plusieurs protons) : H3PO4<o:p></o:p>
<o:p> </o:p>
Base : molécule capter un ou x proton H+<o:p></o:p>
Monobase (capte un proton) : HO- / NH3<o:p></o:p>
Polybase (capte plusieurs protons) : CO32-<o:p></o:p>
<o:p> </o:p>
Quand équilibre chimique on a = ou ó<o:p></o:p>
Quand la réaction est totale on a à<o:p></o:p>
<o:p> </o:p>
II) Les réactions acide / base<o:p></o:p>
Les réactions chimiques sont associées à un équilibre chimique. L’équilibre chimique est associé à des réactifs et à des produits.<o:p></o:p>
Les réactions acide base sont la somme des deux demi réactions :<o:p></o:p>
AH = A- + H+ <o:p></o:p>
B- + H+ = BH<o:p></o:p>
<o:p> </o:p>
Un acide et une base peuvent donc réagir ensemble :<o:p></o:p>
AH + B- = BH + A-<o:p></o:p>
<o:p> </o:p>
1) L’autoprotolyse de l’eau<o:p></o:p>
L’eau est une molécule particulière qui peut à la fois agir comme base et comme acide on a donc ce que l’on appelle l’autoprotolyse de l’eau<o:p></o:p>
2 H2O = H3O+ + HO-<o:p></o:p>
<o:p> </o:p>
Les réactions chimiques sont liées à une constante d’équilibre<o:p></o:p>
Keau = [H30+].[HO-] = 10-14 à condition normales de température et pression <o:p></o:p>
<o:p> </o:p>
2) Fort / Faible<o:p></o:p>
Ces réactions sont équilibrées et elle peut plus ou moins être décalé. Être fort ou faible <o:p></o:p>
<o:p> </o:p>
a) Acide fort<o:p></o:p>
Acide fort : réagit totalement avec l’eau qui joue le rôle de base<o:p></o:p>
AH + H2O à A- + H3O+<o:p></o:p>
<o:p> </o:p>
b) Base forte<o:p></o:p>
Base forte : réagit totalement avec l’eau qui joue le rôle d’acide<o:p></o:p>
A- + H2O à AH + HO-<o:p></o:p>
<o:p> </o:p>
Ces base et acide fort ‘’n’ont pas’’ de constante d’équilibre normale (elles peuvent donc être très négatives è tend vers l’infini)<o:p></o:p>
<o:p> </o:p>
c) Acide faible<o:p></o:p>
Acide faible : réagissent que partiellement avec l’eau (elle est donc équilibré) :<o:p></o:p>
AH + H2O = A- + H3O+<o:p></o:p>
La constante d’acidité est une constante d’équilibre lié à un acide (produit des concentrations des produits diviser par les concentrations des réactions sans H20) : <o:p></o:p>
d) Base faible<o:p></o:p>
Même chose pour la constante de basicité Base faible <o:p></o:p>
A- + H2O = AH + HO-<o:p></o:p>
<o:p> </o:p>
3) Acides et bases conjuguées<o:p></o:p>
On remarque que Kbasicité = Keau / Kacidité<o:p></o:p>
La connaissance de Kbasicité implique celle de Kacidité pour un couple acide base<o:p></o:p>
Kacidité est égale à une valeur numérique, c’est un indicateur de la force d’un acide ou d’une base en solution aqueuse<o:p></o:p>
On emploie aussi le pKacidité = -log Kacidité qui est plus simple à manipuler.<o:p></o:p>
Plus le pKacidité est petit plus l’acide de ce couple est fort (et inversement)<o:p></o:p>
<o:p> </o:p>
III) Le pH<o:p></o:p>
Le pH est un nombre qui donne la quantité de proton libre dans une solution <o:p></o:p>
pH = -log [H3O+]<o:p></o:p>
<o:p> </o:p>
Si [H3O+] = [HO-] è la solution est neutre è 10-7 mol.L-1 è ph 7<o:p></o:p>
Si [H3O+] < [HO-] è la solution est basique<o:p></o:p>
Si [H3O+] > [HO-] è la solution est acide<o:p></o:p>
<o:p> </o:p>
Le pH est une grandeur physico chimique de référence, elle est contrôle et contrôlable. Le pH est utilisé dans les approches biomédicales, certains pH doivent être tamponnés (7,35 < pH sang < 7,45 et 7,9 < pH liquide céphalo rachidien < 8,1)<o:p></o:p>
<o:p> </o:p>
1) Prédominance des espèces<o:p></o:p>
La prédominance d’une espèce A sur B est quand la concentration de l’une par rapport à l’autre.<o:p></o:p>
On compare donc les concentrations A et AH<o:p></o:p>
<o:p> </o:p>
On en déduit que AH prédomine sur A si [AH] > [A-] soit pH < pKacidité<o:p></o:p>
On en déduit que A- prédomine sur AH si [A-] > [AH] soit pH > pKacidité<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
2) Espèce majoritaire :<o:p></o:p>
Une espèce est majoritaire quand [A] > 10 [B]<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
AH est majoritaire devant A- lorsque [AH] > 10 [A-] soit pH < pKacidité – 1 (on peut négliger [A-] devant [AH])<o:p></o:p>
A- est majoritaire devant AH lorsque [A-] > 10 [AH] soit pH > pKacidité + 1 (on peut négliger [AH] devant [A-])<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
IV) La mesure du pH :<o:p></o:p>
Il existe plusieurs types de mesure du pH<o:p></o:p>
- Le papier pH (environ une unité de pH) c’est simple et rapide. La bandelette change de couleur suivant le pH<o:p></o:p>
- Le pH-mètre (entre 0,01 unité de pH) précis mais long car il doit être étalonner au préalable. Les électrodes envoient du courant dans la solution en fonction de la concentration en ion H+<o:p></o:p>
La différence de potentiel est donc proportionnelle à la concentration en ion H+ ou au pH.<o:p></o:p>
ΔE = a.(pH) + b<o:p></o:p>
<o:p> </o:p>
V) Calcul du pH<o:p></o:p>
1) acide / base forte<o:p></o:p>
tableau d’avancement<o:p></o:p>
pH = -log [H3O+] = - log Cacide<o:p></o:p>
pH = 14 + log Cbasicité (pour la base forte)<o:p></o:p>
<o:p> </o:p>
2) acide faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
Ka = h2 / (Ca –h)<o:p></o:p>
Si constante d’acidité est très petite (K < 10-3 ou pKacidité >3) è AH est très faiblement dissocié : [A-] << [AH] è h est négligeable devant Ca<o:p></o:p>
On peut écrire Ka = h2 / Cacidité<o:p></o:p>
pH = ½ (pKacidité – log Cacidité)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (K > 10-3 ou pKacidité < 3) è ne peut pas négliger h devant Ca<o:p></o:p>
h2 + Ka .h – Ka . Ca = 0<o:p></o:p>
<o:p> </o:p>
3) Base faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
K = ([AH].[HO-])/[A-] = ω2 / Cb- ω = Ke/ Ka<o:p></o:p>
<o:p> </o:p>
Si constante de basicité est très petite (Kb < 10-3 ou Ka > 10-11) è A- est très faiblement protoné: [AH] << [A-] è w est négligeable devant Cb<o:p></o:p>
On peut écrire Ka = ω2 / Cb = Ke / Ka<o:p></o:p>
pH = 7 + ½ (pKacidité + log Ca)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (Kb > 10-3 ou Kacidité < 10-11) è A- n’est plus très faiblement protoné <o:p></o:p>
ω2 + Ke/pKacidité .ω – Ke/pKacidité . Cb = 0<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VI) Polyacide <o:p></o:p>
Un polyacide est un mélange de deux acides, ils peuvent donc céder plusieurs protons.<o:p></o:p>
Si ΔpKacidité > 2, c’est la première acidité fixera le ph, on calcule du pH d’un monoacide faible<o:p></o:p>
pH = ½ (pKacidité – log Ca)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VII) Ampholyte<o:p></o:p>
Un ampholyte est un composé qui joue le rôle de base et d’acide.<o:p></o:p>
Quand on cherche le pH d’un ampholyte ça revient à faire le mélange de deux couple acide / base. Ce composé aura deux constantes d’acidité Ka1 et Ka2<o:p></o:p>
(1) AH- + AH- = AH2 + A2- è K1<o:p></o:p>
(2) AH- + H2O = AH2 + HO- è K2<o:p></o:p>
(3) AH- + H2O = A2- + H3O+ è K3<o:p></o:p>
<o:p> </o:p>
Cas particulier : 1 est prépondérante c’est à dire qu’il y a un équilibre entre l’acide et la base, les constantes d’équilibre entre (2) et (3) deviennent négligeables.<o:p></o:p>
K1 > 10^3 K2 <o:p></o:p>
K1 > 10^3 K3<o:p></o:p>
<o:p> </o:p>
Si (1) prépondérante <o:p></o:p>
Tableau d’avancement<o:p></o:p>
Ka1 . Ka2 = [H30+]2<o:p></o:p>
pH = ½ (pKa1 + pKa2)<o:p></o:p>
<o:p> </o:p>
VIII)Mélange de deux solutions<o:p></o:p>
Mélange de deux acides en quantités équivalentes peuvent être de plusieurs natures différentes<o:p></o:p>
1er cas : 2 acides forts pH = - log (C1 + C2)<o:p></o:p>
2ème cas : 1 acide fort avec 1 acide faible. L’acide fort est prépondérant pH = - log Cfort<o:p></o:p>
3ème cas : 2 acides faibles <o:p></o:p>
ΔpKa > 2 è le pH est dicté par l’acide le plus fort (pKa le plus petit) è pH = ½ (pK1 - log Ca)<o:p></o:p>
ΔpKa < 2 è pH = -1/2 log (Ka1 . C1 + KA2 + C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Mélange acide base conjuguée (solution tampon)<o:p></o:p>
pH = pKa + log [Cb]/[Ca]<o:p></o:p>
<o:p> </o:p>
B) Mélange acide base non conjuguée<o:p></o:p>
Tableau d’avancement<o:p></o:p>
K = KA1 / KA2<o:p></o:p>
<o:p> </o:p>
Si K < 10^-3, soit pKa > 3<o:p></o:p>
pH = ½ (pKA1 + pKA2) + ½ log (C2/C1)<o:p></o:p>
Si C1 = C2 è pH = ½ (pKA1 + pKA2)<o:p></o:p>
<o:p> </o:p>
Si K > 10^-3, soit pKa < 3, il faudra résoudre<o:p></o:p>
K = x^2 / (C1-x).(C2-x)<o:p></o:p>
<o:p> </o:p>
IX) Les titrages acido-basiques<o:p></o:p>
J’ai une solution connue et une solution inconnue je verse goutte à goutte la solution connue dans la solution inconnue jusqu’à un changement de couleur ou jusqu’à obtenir une courbe en S (avec le point équivalent)<o:p></o:p>
<o:p> </o:p>
A) Acide fort titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide fort et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
Quand on verse autant de moles de base que d’acide on obtient le point équivalent. On dit que l’acide et la base ont été mélangés dans des proportions stoechiométriques.<o:p></o:p>
ninitial = najouté<o:p></o:p>
ó Ca . Va = Cb . Vb<o:p></o:p>
<o:p> </o:p>
1) Courbe de titrage <o:p></o:p>
Elle représente l’évolution du pH en fonction du volume de base versée.<o:p></o:p>
Schéma<o:p></o:p>
Avant point équivalent pH acide <o:p></o:p>
Après point équivalent pH basique<o:p></o:p>
<o:p> </o:p>
2) Point équivalent (d’un point de vue graphique)<o:p></o:p>
Méthode des tangentes<o:p></o:p>
Tangente bas / tangente parallèle haut è parallèle au milieu = point équivalent<o:p></o:p>
<o:p> </o:p>
3) pH à différents points de la courbe<o:p></o:p>
V=0 pH acide fort pH = -log [H3O+] = - log Ca<o:p></o:p>
0 < Vb < Veq pH = - log (Cb. (Veq – Vb)/(Vb + Va)<o:p></o:p>
Vb = Veq pH = 7<o:p></o:p>
Vb > Veq è pH = 14 + log (Cb. (Vb – Veq)/ (Vb+Va))<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Acide faible titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide faible et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
La courbe n’est plus symétrique, elle possède donc deux points d’intérêt : <o:p></o:p>
Le point équivalent (méthode des tangentes)<o:p></o:p>
Le point demi-équivalent qui correspond à pH = pKa<o:p></o:p>
<o:p> </o:p>
X) Solution tampon / pouvoir tampon<o:p></o:p>
Une solution tampon est une solution où le pH varie peu dans deux cas :<o:p></o:p>
Par addition d’un acide ou d’une base forte<o:p></o:p>
Par dilution modérée (eau)<o:p></o:p>
<o:p> </o:p>
Quand on fait un mélange équimolaire d’un acide faible et de sa base conjuguée, on se retrouve à la demi équivalence. C’est la meilleure solution pour créer une solution tampon<o:p></o:p>
<o:p> </o:p>
A) Préparation solution tampon<o:p></o:p>
1/ acide faible + base conjuguée en quantité égale<o:p></o:p>
2/ base faible + acide fort jusqu’à demi équivalence<o:p></o:p>
3/ acide faible + base forte jusqu’à demi équivalence<o:p></o:p>
<o:p> </o:p>
B) Solution tampon en biologie<o:p></o:p>
Le sang humain est tamponné à 7,4, il est régulé par deux couples H2PO4- / HPO42- et CO2 dissous / HCO3-<o:p></o:p>
<o:p> </o:p>
Si pH < 7,4 è acidose<o:p></o:p>
Si pH > 7,4 è alcalose (solution basique = solution alcaline)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Changement d’état <o:p></o:p>
Un corps peut se trouver sous 3 formes :<o:p></o:p>
- solide<o:p></o:p>
- liquide <o:p></o:p>
- gazeux<o:p></o:p>
<o:p> </o:p>
On peut représenter les transitions entre les différents états par un diagramme de phase.
<o:p> </o:p>
Pas de perte ou de création d’énergie<o:p></o:p>
L’énergie de solidification + l’énergie de sublimation = l’énergie de vaporisation <o:p></o:p>
 votre commentaire
votre commentaire
-
Les couples acides bases<o:p></o:p>
<o:p> </o:p>
I) Définition <o:p></o:p>
Acide : molécule qui cède une ou x protons H+<o:p></o:p>
Monoacide (perd un proton) : NH4+ / H2O<o:p></o:p>
Polyacide (perd plusieurs protons) : H3PO4<o:p></o:p>
<o:p> </o:p>
Base : molécule capter un ou x proton H+<o:p></o:p>
Monobase (capte un proton) : HO- / NH3<o:p></o:p>
Polybase (capte plusieurs protons) : CO32-<o:p></o:p>
<o:p> </o:p>
Quand équilibre chimique on a = ou ó<o:p></o:p>
Quand la réaction est totale on a à<o:p></o:p>
<o:p> </o:p>
II) Les réactions acide / base<o:p></o:p>
Les réactions chimiques sont associées à un équilibre chimique. L’équilibre chimique est associé à des réactifs et à des produits.<o:p></o:p>
Les réactions acide base sont la somme des deux demi réactions :<o:p></o:p>
AH = A- + H+ <o:p></o:p>
B- + H+ = BH<o:p></o:p>
<o:p> </o:p>
Un acide et une base peuvent donc réagir ensemble :<o:p></o:p>
AH + B- = BH + A-<o:p></o:p>
<o:p> </o:p>
1) L’autoprotolyse de l’eau<o:p></o:p>
L’eau est une molécule particulière qui peut à la fois agir comme base et comme acide on a donc ce que l’on appelle l’autoprotolyse de l’eau<o:p></o:p>
2 H2O = H3O+ + HO-<o:p></o:p>
<o:p> </o:p>
Les réactions chimiques sont liées à une constante d’équilibre<o:p></o:p>
Keau = [H30+].[HO-] = 10-14 à condition normales de température et pression <o:p></o:p>
<o:p> </o:p>
2) Fort / Faible<o:p></o:p>
Ces réactions sont équilibrées et elle peut plus ou moins être décalé. Être fort ou faible <o:p></o:p>
<o:p> </o:p>
a) Acide fort<o:p></o:p>
Acide fort : réagit totalement avec l’eau qui joue le rôle de base<o:p></o:p>
AH + H2O à A- + H3O+<o:p></o:p>
<o:p> </o:p>
b) Base forte<o:p></o:p>
Base forte : réagit totalement avec l’eau qui joue le rôle d’acide<o:p></o:p>
A- + H2O à AH + HO-<o:p></o:p>
<o:p> </o:p>
Ces base et acide fort ‘’n’ont pas’’ de constante d’équilibre normale (elles peuvent donc être très négatives è tend vers l’infini)<o:p></o:p>
<o:p> </o:p>
c) Acide faible<o:p></o:p>
Acide faible : réagissent que partiellement avec l’eau (elle est donc équilibré) :<o:p></o:p>
AH + H2O = A- + H3O+<o:p></o:p>
La constante d’acidité est une constante d’équilibre lié à un acide (produit des concentrations des produits diviser par les concentrations des réactions sans H20) : <o:p></o:p>
d) Base faible<o:p></o:p>
Même chose pour la constante de basicité Base faible <o:p></o:p>
A- + H2O = AH + HO-<o:p></o:p>
<o:p> </o:p>
3) Acides et bases conjuguées<o:p></o:p>
On remarque que Kbasicité = Keau / Kacidité<o:p></o:p>
La connaissance de Kbasicité implique celle de Kacidité pour un couple acide base<o:p></o:p>
Kacidité est égale à une valeur numérique, c’est un indicateur de la force d’un acide ou d’une base en solution aqueuse<o:p></o:p>
On emploie aussi le pKacidité = -log Kacidité qui est plus simple à manipuler.<o:p></o:p>
Plus le pKacidité est petit plus l’acide de ce couple est fort (et inversement)<o:p></o:p>
<o:p> </o:p>
III) Le pH<o:p></o:p>
Le pH est un nombre qui donne la quantité de proton libre dans une solution <o:p></o:p>
pH = -log [H3O+]<o:p></o:p>
<o:p> </o:p>
Si [H3O+] = [HO-] è la solution est neutre è 10-7 mol.L-1 è ph 7<o:p></o:p>
Si [H3O+] < [HO-] è la solution est basique<o:p></o:p>
Si [H3O+] > [HO-] è la solution est acide<o:p></o:p>
<o:p> </o:p>
Le pH est une grandeur physico chimique de référence, elle est contrôle et contrôlable. Le pH est utilisé dans les approches biomédicales, certains pH doivent être tamponnés (7,35 < pH sang < 7,45 et 7,9 < pH liquide céphalo rachidien < 8,1)<o:p></o:p>
<o:p> </o:p>
1) Prédominance des espèces<o:p></o:p>
La prédominance d’une espèce A sur B est quand la concentration de l’une par rapport à l’autre.<o:p></o:p>
On compare donc les concentrations A et AH<o:p></o:p>
<o:p> </o:p>
On en déduit que AH prédomine sur A si [AH] > [A-] soit pH < pKacidité<o:p></o:p>
On en déduit que A- prédomine sur AH si [A-] > [AH] soit pH > pKacidité<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
2) Espèce majoritaire :<o:p></o:p>
Une espèce est majoritaire quand [A] > 10 [B]<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
AH est majoritaire devant A- lorsque [AH] > 10 [A-] soit pH < pKacidité – 1 (on peut négliger [A-] devant [AH])<o:p></o:p>
A- est majoritaire devant AH lorsque [A-] > 10 [AH] soit pH > pKacidité + 1 (on peut négliger [AH] devant [A-])<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
IV) La mesure du pH :<o:p></o:p>
Il existe plusieurs types de mesure du pH<o:p></o:p>
- Le papier pH (environ une unité de pH) c’est simple et rapide. La bandelette change de couleur suivant le pH<o:p></o:p>
- Le pH-mètre (entre 0,01 unité de pH) précis mais long car il doit être étalonner au préalable. Les électrodes envoient du courant dans la solution en fonction de la concentration en ion H+<o:p></o:p>
La différence de potentiel est donc proportionnelle à la concentration en ion H+ ou au pH.<o:p></o:p>
ΔE = a.(pH) + b<o:p></o:p>
<o:p> </o:p>
V) Calcul du pH<o:p></o:p>
1) acide / base forte<o:p></o:p>
tableau d’avancement<o:p></o:p>
pH = -log [H3O+] = - log Cacide<o:p></o:p>
pH = 14 + log Cbasicité (pour la base forte)<o:p></o:p>
<o:p> </o:p>
2) acide faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
Ka = h2 / (Ca –h)<o:p></o:p>
Si constante d’acidité est très petite (K < 10-3 ou pKacidité >3) è AH est très faiblement dissocié : [A-] << [AH] è h est négligeable devant Ca<o:p></o:p>
On peut écrire Ka = h2 / Cacidité<o:p></o:p>
pH = ½ (pKacidité – log Cacidité)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (K > 10-3 ou pKacidité < 3) è ne peut pas négliger h devant Ca<o:p></o:p>
h2 + Ka .h – Ka . Ca = 0<o:p></o:p>
<o:p> </o:p>
3) Base faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
K = ([AH].[HO-])/[A-] = ω2 / Cb- ω = Ke/ Ka<o:p></o:p>
<o:p> </o:p>
Si constante de basicité est très petite (Kb < 10-3 ou Ka > 10-11) è A- est très faiblement protoné: [AH] << [A-] è w est négligeable devant Cb<o:p></o:p>
On peut écrire Ka = ω2 / Cb = Ke / Ka<o:p></o:p>
pH = 7 + ½ (pKacidité + log Ca)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (Kb > 10-3 ou Kacidité < 10-11) è A- n’est plus très faiblement protoné <o:p></o:p>
ω2 + Ke/pKacidité .ω – Ke/pKacidité . Cb = 0<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VI) Polyacide <o:p></o:p>
Un polyacide est un mélange de deux acides, ils peuvent donc céder plusieurs protons.<o:p></o:p>
Si ΔpKacidité > 2, c’est la première acidité fixera le ph, on calcule du pH d’un monoacide faible<o:p></o:p>
pH = ½ (pKacidité – log Ca)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VII) Ampholyte<o:p></o:p>
Un ampholyte est un composé qui joue le rôle de base et d’acide.<o:p></o:p>
Quand on cherche le pH d’un ampholyte ça revient à faire le mélange de deux couple acide / base. Ce composé aura deux constantes d’acidité Ka1 et Ka2<o:p></o:p>
(1) AH- + AH- = AH2 + A2- è K1<o:p></o:p>
(2) AH- + H2O = AH2 + HO- è K2<o:p></o:p>
(3) AH- + H2O = A2- + H3O+ è K3<o:p></o:p>
<o:p> </o:p>
Cas particulier : 1 est prépondérante c’est à dire qu’il y a un équilibre entre l’acide et la base, les constantes d’équilibre entre (2) et (3) deviennent négligeables.<o:p></o:p>
K1 > 10^3 K2 <o:p></o:p>
K1 > 10^3 K3<o:p></o:p>
<o:p> </o:p>
Si (1) prépondérante <o:p></o:p>
Tableau d’avancement<o:p></o:p>
Ka1 . Ka2 = [H30+]2<o:p></o:p>
pH = ½ (pKa1 + pKa2)<o:p></o:p>
<o:p> </o:p>
VIII)Mélange de deux solutions<o:p></o:p>
Mélange de deux acides en quantités équivalentes peuvent être de plusieurs natures différentes<o:p></o:p>
1er cas : 2 acides forts pH = - log (C1 + C2)<o:p></o:p>
2ème cas : 1 acide fort avec 1 acide faible. L’acide fort est prépondérant pH = - log Cfort<o:p></o:p>
3ème cas : 2 acides faibles <o:p></o:p>
ΔpKa > 2 è le pH est dicté par l’acide le plus fort (pKa le plus petit) è pH = ½ (pK1 - log Ca)<o:p></o:p>
ΔpKa < 2 è pH = -1/2 log (Ka1 . C1 + KA2 + C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Mélange acide base conjuguée (solution tampon)<o:p></o:p>
pH = pKa + log [Cb]/[Ca]<o:p></o:p>
<o:p> </o:p>
B) Mélange acide base non conjuguée<o:p></o:p>
Tableau d’avancement<o:p></o:p>
K = KA1 / KA2<o:p></o:p>
<o:p> </o:p>
Si K < 10^-3, soit pKa > 3<o:p></o:p>
pH = ½ (pKA1 + pKA2) + ½ log (C2/C1)<o:p></o:p>
Si C1 = C2 è pH = ½ (pKA1 + pKA2)<o:p></o:p>
<o:p> </o:p>
Si K > 10^-3, soit pKa < 3, il faudra résoudre<o:p></o:p>
K = x^2 / (C1-x).(C2-x)<o:p></o:p>
<o:p> </o:p>
IX) Les titrages acido-basiques<o:p></o:p>
J’ai une solution connue et une solution inconnue je verse goutte à goutte la solution connue dans la solution inconnue jusqu’à un changement de couleur ou jusqu’à obtenir une courbe en S (avec le point équivalent)<o:p></o:p>
<o:p> </o:p>
A) Acide fort titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide fort et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
Quand on verse autant de moles de base que d’acide on obtient le point équivalent. On dit que l’acide et la base ont été mélangés dans des proportions stoechiométriques.<o:p></o:p>
ninitial = najouté<o:p></o:p>
ó Ca . Va = Cb . Vb<o:p></o:p>
<o:p> </o:p>
1) Courbe de titrage <o:p></o:p>
Elle représente l’évolution du pH en fonction du volume de base versée.<o:p></o:p>
Schéma<o:p></o:p>
Avant point équivalent pH acide <o:p></o:p>
Après point équivalent pH basique<o:p></o:p>
<o:p> </o:p>
2) Point équivalent (d’un point de vue graphique)<o:p></o:p>
Méthode des tangentes<o:p></o:p>
Tangente bas / tangente parallèle haut è parallèle au milieu = point équivalent<o:p></o:p>
<o:p> </o:p>
3) pH à différents points de la courbe<o:p></o:p>
V=0 pH acide fort pH = -log [H3O+] = - log Ca<o:p></o:p>
0 < Vb < Veq pH = - log (Cb. (Veq – Vb)/(Vb + Va)<o:p></o:p>
Vb = Veq pH = 7<o:p></o:p>
Vb > Veq è pH = 14 + log (Cb. (Vb – Veq)/ (Vb+Va))<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Acide faible titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide faible et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
La courbe n’est plus symétrique, elle possède donc deux points d’intérêt : <o:p></o:p>
Le point équivalent (méthode des tangentes)<o:p></o:p>
Le point demi-équivalent qui correspond à pH = pKa<o:p></o:p>
<o:p> </o:p>
X) Solution tampon / pouvoir tampon<o:p></o:p>
Une solution tampon est une solution où le pH varie peu dans deux cas :<o:p></o:p>
Par addition d’un acide ou d’une base forte<o:p></o:p>
Par dilution modérée (eau)<o:p></o:p>
<o:p> </o:p>
Quand on fait un mélange équimolaire d’un acide faible et de sa base conjuguée, on se retrouve à la demi équivalence. C’est la meilleure solution pour créer une solution tampon<o:p></o:p>
<o:p> </o:p>
A) Préparation solution tampon<o:p></o:p>
1/ acide faible + base conjuguée en quantité égale<o:p></o:p>
2/ base faible + acide fort jusqu’à demi équivalence<o:p></o:p>
3/ acide faible + base forte jusqu’à demi équivalence<o:p></o:p>
<o:p> </o:p>
B) Solution tampon en biologie<o:p></o:p>
Le sang humain est tamponné à 7,4, il est régulé par deux couples H2PO4- / HPO42- et CO2 dissous / HCO3-<o:p></o:p>
<o:p> </o:p>
Si pH < 7,4 è acidose<o:p></o:p>
Si pH > 7,4 è alcalose (solution basique = solution alcaline)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Changement d’état <o:p></o:p>
Un corps peut se trouver sous 3 formes :<o:p></o:p>
- solide<o:p></o:p>
- liquide <o:p></o:p>
- gazeux<o:p></o:p>
<o:p> </o:p>
On peut représenter les transitions entre les différents états par un diagramme de phase.
<o:p> </o:p>
Pas de perte ou de création d’énergie<o:p></o:p>
L’énergie de solidification + l’énergie de sublimation = l’énergie de vaporisation <o:p></o:p>
 votre commentaire
votre commentaire
-
Introduction à la biochimie<o:p></o:p>
<o:p> </o:p>
Biochimie = étude des substances et des procédés chimiques produit dans l’organisme vivant (espace vivant) qui en continuel renouvellement<o:p></o:p>
<o:p> </o:p>
L’étude des substances se fait par :<o:p></o:p>
- Identification<o:p></o:p>
- Localisation<o:p></o:p>
- Structure<o:p></o:p>
<o:p> </o:p>
Tout ça se fait par des mécanismes réactionnels (réactions chimiques) qui sont nécessaires à la survie de la cellule.<o:p></o:p>
<o:p> </o:p>
La survie de la cellule se fait sur un tryptique :<o:p></o:p>
- Molécules de base<o:p></o:p>
- Energie<o:p></o:p>
- Mécanismes réactionneles<o:p></o:p>
<o:p> </o:p>
/ !\ il n’y a pas de réaction indépendantes<o:p></o:p>
<o:p></o:p>
L’énergie et la matière sont à générer en même temps
L'énergie vient des nutriments (GPL ayant un haut poids moléculaire / macromolécules riche en énergie) qui vont se dégrader.<o:p></o:p>
<o:p></o:p>
/ !\ La cellule ne gaspille rien (énergie / molécules)<o:p></o:p>
<o:p> </o:p>
Homéostasie è constance d’un concentration <o:p></o:p>
Si altération de l’homéostasie, il y a pathologie<o:p></o:p>
 votre commentaire
votre commentaire
-
Bioénergétique<o:p></o:p>
<o:p> </o:p>
Énergie utile / libre : énergie pour réaliser un travail, c’est un échange il n’y a pas de perte.<o:p></o:p>
Énergie cellulaire : perte sus forme de chaleur.<o:p></o:p>
<o:p> </o:p>
L’énergie est apportée par l’alimentation.<o:p></o:p>
La cellule est un système ouvert, c’est à dire qu’il y a un échange avec le milieu extérieur à pression et température constante.<o:p></o:p>
<o:p> </o:p>
I) Couplage énergétique <o:p></o:p>
Il n’y a pas de réaction indépendante et aléatoire, il existe une voie métabolique.<o:p></o:p>
La réaction a toujours la même finalité<o:p></o:p>
<o:p> </o:p>
La réaction a des contraintes énergétiques suivant les lois de la thermodynamique.<o:p></o:p>
Elles sont alors réparties lors du bilan final de la voie métabolique.<o:p></o:p>
Pour effectuer une réaction on doit atteindre un niveau d’énergie qui respecte les lois de la thermodynamique. <o:p></o:p>
Quand la variation d’énergie ou le niveau d’activation est trop important cela est incompatible avec la cellule è on utilise donc un catalyseur qui est une enzyme spécifique à la réaction è elle facilite la réaction en puisant un minimum d’énergie.<o:p></o:p>
<o:p> </o:p>
On peut utiliser aussi le découplage réactionnel qui diminue les barrières énergétiques et empêche la dispersion d’énergie sous forme de chaleur.<o:p></o:p>
<o:p> </o:p>
Lors du catabolisme l’énergie libérée est capté et est transporté par l’ATP.<o:p></o:p>
<o:p> </o:p>
Il existe deux variations d’énergie quand on a une réaction : - cinétique : réalise un travail<o:p></o:p>
- potentielle : contenue dans une macromolécule<o:p></o:p>
<o:p> </o:p>
· Les lois de la thermodynamique<o:p></o:p>
L’énergie totale doit être constante<o:p></o:p>
L’entropie augmente, elle tend vers le désordre<o:p></o:p>
L’équation de Gibbs est alors modifié :<o:p></o:p>
 <o:p></o:p>
<o:p></o:p>Si ΔG = 0 la réaction est fini<o:p></o:p>
Si ΔG ≠ 0 la réaction est en cours<o:p></o:p>
ΔG permet de dire le sens de la réaction : ΔG > 0 la réaction est endergonique / instable<o:p></o:p>
ΔG < 0 la réaction est exergonique / apport d’énergie<o:p></o:p>
La voie métabolique doit être exergonique.<o:p></o:p>
On calcule donc ΔG = ΔG0 + RT ln[B]/[A]<o:p></o:p>
Avec ΔG0 l’état standard pH = 0, T = 25°C, P = 1 atm et à 1 mol.L-1 è ce n’est pas possible dans la cellule sauf en cas d’oxydo-réduction)<o:p></o:p>
<o:p> </o:p>
II) Type de réaction <o:p></o:p>
1) Réversible <o:p></o:p>
|ΔG| faible <o:p></o:p>
<o:p> </o:p>
2) Irréversible<o:p></o:p>
|ΔG| important avec une quantité d’énergie quand A à B<o:p></o:p>
<o:p> </o:p>
Les réactions du type A à B à C à D à E sont réversibles et irréversibles (en amont).<o:p></o:p>
Cela permet de répondre aux contraintes énergétiques, de rendre A irréversible et de permettre à l’enzyme qui catalyse d’exercer sa fonction de régulation<o:p></o:p>
<o:p> </o:p>
Ainsi on a une barrière qui empêche la réaction de se faire spontanément è l’énergie d’activation.<o:p></o:p>
Exemple : Chauffage è Éther (Énergie d’activation faible) s’enflamme<o:p></o:p>
Sucre (Énergie d’activation important) a besoin de beaucoup de chaleur pour se dégrader<o:p></o:p>
<o:p> </o:p>
Phosphorylation è Glucose ne peut pas sortir de la cellule et a un niveau énergétique élevé.<o:p></o:p>
<o:p> </o:p>
On effectue alors un couplage réactionnel à l’hydrolyse : ATP à ADP + Pi<o:p></o:p>
L’ATP est une molécule à fort potentiel énergétique (ΔG = -31 kJ.mol-1). <o:p></o:p>
On apporte autant d’ATP que nécessaire pour une réaction<o:p></o:p>
<o:p> </o:p>
III) Étude d’une molécule à haut potentiel d’énergie (HPE)<o:p></o:p>
Dans chaque réaction il y a dispersion d’énergie (chaleur)<o:p></o:p>
La cellule est un espace ouvert qui travaille à état stationnaire pour survivre<o:p></o:p>
- Etat stationnaire : lutte contre l’entropie, la grandeur reste constante<o:p></o:p>
- Etat d’équilibre : mort cellulaire<o:p></o:p>
<o:p> </o:p>
Loi de Lechatelier = loi d’action de masse è quand il y a augmentation de A il y a augmentation de E<o:p></o:p>
<o:p> </o:p>
Il n’y a pas de dégradation, pas de création mais il y a transformation.<o:p></o:p>
Une voie métabolique peut être inversée<o:p></o:p>
<o:p> </o:p>
1) Liaison HPE<o:p></o:p>
Liaison phosphoanhydre<o:p></o:p>
Quand est hydrolysé : libère beaucoup d’énergie<o:p></o:p>
ATP en possède 2<o:p></o:p>
Liaison thioester<o:p></o:p>
Fixation d’un COOH sur un SH du CoA<o:p></o:p>
Hydrolyse les AG<o:p></o:p>
Liaison amidine phosphate<o:p></o:p>
Créatine sous forme phosphorylé<o:p></o:p>
Liaison enol-phosphate<o:p></o:p>
-60 kJ è c’est la molécule la plus énergétique<o:p></o:p>
elle est présente dans la dernière étape de la glycolyse<o:p></o:p>
<o:p> </o:p>
2) L’ATP<o:p></o:p>
C’est un transporteur universel d’énergie<o:p></o:p>
Il est présent dans toutes les cellules (75g/jour pour 45kg)<o:p></o:p>
3 liaisons : 2 phosphoanhydre (β et γ) et 1 phosphoester (α)<o:p></o:p>
Il y a un turn over è création de 10 ATP pour 1 ADP<o:p></o:p>
C’est une moléucle instable qui a 4 charges - è tend vers vers la stabilité par hydrolyse<o:p></o:p>
<o:p> </o:p>
/ !\ l’ADP ne donne jamais d’énergie par hydrolyse<o:p></o:p>
L’AMP relié à un sucre par une liaison thioester est une molécule HPE<o:p></o:p>
<o:p> </o:p>
· La synthèse d’ATP<o:p></o:p>
Rephosphorylation de l’AMP et de l’ADP<o:p></o:p>
Transfert du phosphate de la GTP sur ADP <o:p></o:p>
Oxydation phosphorylante<o:p></o:p>
<o:p> </o:p>
Phosphorylation liée au substrat<o:p></o:p>
Dans les cellules exprimant la créatine phosphokinase<o:p></o:p>
Adénylate kinase<o:p></o:p>
Dans le muscle strié<o:p></o:p>
Turn over<o:p></o:p>
Molécule considérée comme HPE quand E > 31kJè transfert vers ATP<o:p></o:p>
à Transfert phosphate sur substrat<o:p></o:p>
à Hydrolyse phosphate : non nécessaire à la réaction<o:p></o:p>
SCHEMA<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
IV) Voie anaérobie alactique (molécules impliqués)<o:p></o:p>
1) Créatine phosphate<o:p></o:p>
- Réserve la plus mobilisable des muscles (provient de l’ATP mitochondrial qui régénère l’énergie de l’ATP cytoplasmique)<o:p></o:p>
- Structure è synthétisé à partir des AA puis transféré à l’ATP<o:p></o:p>
- État basal è la cellule a teminé son travail et reconstitué ses réserves (niveau énergétique créatine > créatine P)<o:p></o:p>
<o:p> </o:p>
CPK créatine phosphokinase (catalyse les réactions irréversibles)<o:p></o:p>
· CPK-2 (dimère)<o:p></o:p>
- soluble dans le cytosol et dans l’espace inter-membranaire<o:p></o:p>
- présente lors de l’effort (déphosphorylation)<o:p></o:p>
<o:p> </o:p>
· CPK-8 (octamère)<o:p></o:p>
- phosphorylation lors du repos è reconstitue réserve énergétique<o:p></o:p>
<o:p> </o:p>
* durant le travail <o:p></o:p>
consomme ATP è CPK-2 dans cytosol<o:p></o:p>
SCHEMA<o:p></o:p>
<o:p> </o:p>
* quand travail terminé<o:p></o:p>
pas de consomation d’ATP è CPK-8 dans membrane inter-mitochondriale<o:p></o:p>
SCHEMA<o:p></o:p>
<o:p> </o:p>
2) Adénylate kinase / Myokinase<o:p></o:p>
*Dans cytosol<o:p></o:p>
SCHEMA<o:p></o:p>
MK et CPK sont utilisé dans des voies métaboliques courtes en anaérobie<o:p></o:p>
<o:p> </o:p>
Début effort<o:p></o:p>
Récupération<o:p></o:p>
Substrat<o:p></o:p>
ADP – Créatine P<o:p></o:p>
ATP – AMP – Créatine<o:p></o:p>
Produit<o:p></o:p>
ATP – AMP - Créatine<o:p></o:p>
ADP – Créatine P<o:p></o:p>
<o:p> </o:p>
*Détails<o:p></o:p>
L’ATP atteint 0% en 1 minute<o:p></o:p>
La voie anaérobie alactique est rapide pour crée de l’ATP à partir de créatine P<o:p></o:p>
<o:p> </o:p>
Créatine P + 3 ADP + H+ ó Créatine + 2 ATP + AMP<o:p></o:p>
/ !\ AMP et Ca2+ sont des médiateurs<o:p></o:p>
<o:p> </o:p>
V) Potentiel redox<o:p></o:p>
L’oxydation est la perte d’un électron ou d’un H+ è l’élément est réducteur è il s’oxyde<o:p></o:p>
La réduction est le gain d’un électron ou d’un H+ è l’élément est oxydant è il se réduit<o:p></o:p>
AH2 è A + 2H+ + 2e<o:p></o:p>
B + 2H+ + 2e è BH2<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Au niveau de la CRM et PO (phosphorylation oxydative) il y a transfert d’électron<o:p></o:p>
FADH2 è 2 ATP<o:p></o:p>
NADH è 3 ATP<o:p></o:p>
 votre commentaire
votre commentaire