-
Chapitre 9 - Temps et évolution chimique : cinétique et catalyse
Chapitre 9<o:p></o:p>
Temps et évolution chimique : cinétique et catalyse<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Durée de réaction<o:p></o:p>
1) Réaction lente et rapide<o:p></o:p>
Au cours d’une réaction chimique le système évolue :<o:p></o:p>
- initial : réactif mis en contact<o:p></o:p>
- final : composition du système ne change plus<o:p></o:p>
<o:p> </o:p>
La durée est très variable entre deux états<o:p></o:p>
La réaction lente ou rapide est choisi arbitrairement par l’expérimentateur (une réaction rapide met moins d’une seconde pour se faire)<o:p></o:p>
La cinétique chimique est l’étude du caractère plus ou moins rapide des transformations chimiques.<o:p></o:p>
<o:p> </o:p>
2) Évolution de la quantité de matière au cours du temps<o:p></o:p>
Plus l’avancement augmente plus les produits augmentent et les réactifs diminuent.<o:p></o:p>
Pour connaître la quantité de matière :<o:p></o:p>
- on peut utiliser un spectrophotomètre (pour les solutions colorées)<o:p></o:p>
- on peut utiliser des dosages<o:p></o:p>
- on peut utiliser un pH-mètre<o:p></o:p>
<o:p> </o:p>
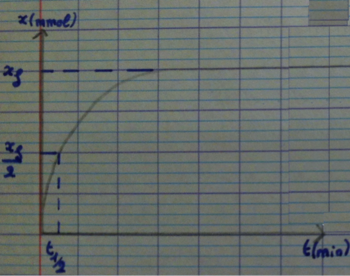
3) Temps de demie réaction<o:p></o:p>
Le temps de demie réaction notée t½ est la durée au bout de laquelle l’avancement de la réaction vaut la moitié de sa valeur finale xf<o:p></o:p>
x(½) = xf / 2 <o:p></o:p>
Les systèmes chimiques cessent d’évoluer à quelques dizaines de t½ (le temps de demie-réaction est différente de la moitié du temps de la réaction.<o:p></o:p>
<o:p> </o:p>
Détermination d’un temps de demie réaction<o:p></o:p>
Il s’obtient graphiquement à partir d’une courbe de l’avancement au cours du temps.<o:p></o:p>
Un oxydant est réduit donc il gagne des électrons<o:p></o:p>
Un réducteur perd des électrons.<o:p></o:p>
H2O2 / H2O<o:p></o:p>
I2 / I-<o:p></o:p>
<o:p> </o:p>
2I- = I2 + 2e-<o:p></o:p>
2H+ + H2O2 + 2e- = 2H2O<o:p></o:p>
2H+ + H2O2 + 2I-
 I2 + 2H2O<o:p></o:p>
I2 + 2H2O<o:p></o:p><o:p> </o:p>
Par spectroscopie on peut suivre la concentration de I2 en fonction du temps et suivre l’avancement<o:p></o:p>
On peut faire pareil avec un réactif<o:p></o:p>
Choix de la technique de suivie et temps de suivie et temps de demie réaction<o:p></o:p>
Il faut que le temps de réponse de la technique ou de l’appareil doit être très inférieur au temps de demi réaction de la transformation<o:p></o:p>
Exemple : les appareils de mesure tels que le pH-mètre et le spectrophotomètre ne fournissent pas de résultats instantanées. Le temps de réponse d’une électrode de pH-mètrie met 20 secondes.<o:p></o:p>
<o:p> </o:p>
II) Facteurs cinétiques<o:p></o:p>
Un facteur cinétique est un paramètre expérimental qui a une influence sur la durée d’une réaction : la température, la concentration, le solvant sont des facteurs cinétiques.<o:p></o:p>
Les industriels doivent limiter les couts et le temps de la transformations ce qui permet d’augmenter la rentabilité.<o:p></o:p>
<o:p> </o:p>
1) Influence de la concentration<o:p></o:p>
En général plus la concentration initiale des réactifs est élevé plus la durée de réaction est faible<o:p></o:p>
<o:p> </o:p>
2) Influence de la température<o:p></o:p>
En général une augmentation du milieu réactionnel entraine une diminution de la durée de réaction<o:p></o:p>
<o:p> </o:p>
Ex : de nombreux montages de synthèses comme le chauffage à reflux qui maintient le mélange réactionnel à température d’ébullition du solvant et évite la perte de matière. Les espèces chimiques volatiles se condensent dans le réfrigérant et tombe dans le ballon.<o:p></o:p>
<o:p> </o:p>
L’effet inverse est exploité pour la conservation des aliments qui sont maintenu à 4°C au réfrigérateur et -18°C au congélateur.<o:p></o:p>
Toutes les réactions chimiques qui sont responsables de l’altération sont ralenties ce qui permet la conservation.<o:p></o:p>
<o:p> </o:p>
3) Influence du solvant<o:p></o:p>
Il a un rôle essentiel : celui de solubiliser les réactifs pour favoriser leur contact et parfois il est susceptible d’interagir avec les espèces chimiques et d’altérer le transformateur.<o:p></o:p>
Le choix du solvant influe sur la durée de réaction.<o:p></o:p>
<o:p> </o:p>
III) Catalyse<o:p></o:p>
Définition : un catalyseur est une espèce chimique qui diminue la durée de réaction dans le milieu réactionnel où il est introduit. Il n’apparaît pas dans l’équation de la réaction.<o:p></o:p>
La quantité de catalyseur est identique à l’état initial et final, il est consommé puis régénéré.<o:p></o:p>
Un catalyseur fragilise certaines liaisons chimiques pour faciliter au réactif la transformation.<o:p></o:p>
Un catalyseur agit uniquement sur la vitesse, il permet d’atteindre plus vite l’état final sans en modifier sa composition.<o:p></o:p>
Convenablement choisi, il peut aussi éviter des réaction parasites, on parle alors de catalyse sélective.<o:p></o:p>
Deux espèces sont dans la même phase si leur mélange est homogène.<o:p></o:p>
<o:p> </o:p>
1) Catalyse hétérogène<o:p></o:p>
Quand les réactifs et le catalyseur se situe dans des phases différentes la catalyse est dite hétérogène le plus souvent le catalyseur est solide.<o:p></o:p>
Les réactifs sont liquides ou gaz. Quand le catalyseur est sous une forme différente des réactifs, on peut les séparer facilement.<o:p></o:p>
Ce sont des métaux qui augmentent fortement le cout de la synthèse comme fer qui est le catalyseur de l’ammoniac et du pot catalytique.<o:p></o:p>
<o:p> </o:p>
2) Catalyse homogène<o:p></o:p>
Quand les réactifs et le catalyseur se situe tous dans la même phase, la catalyse est dite homogène le plus souvent le catalyseur est liquide.<o:p></o:p>
Elle est d’autant plus efficace qu’elle est concentrée. Ils sont moins couteux mais difficile à extraire comme l’acide sulfurique<o:p></o:p>
<o:p> </o:p>
3) Catalyse enzymatique<o:p></o:p>
Les enzymes sont des catalyseurs biologiques : elle joue un rôle primordial chez les êtres vivants en accélérant les réactions chimiques du métabolisme. Le plus souvent ce sont des protéines. Elle est très efficace et sélective. Il agissant sous des conditions « douces » : milieu aqueux, température basse, pH de 7 è intérêt croissant.<o:p></o:p>
Elle évite les dépenses d’énergie et le recours à des solvants nocifs.<o:p></o:p>
Ex : la plupart des lessives contiennent des protéases qui catalysent les produits qui sont responsables de la dégradation des protéines d’origine organique (tache de sang, herbe). Les lessives à froid utilise des enzymes extraites de bactéries etc…<o:p></o:p>
-
Commentaires