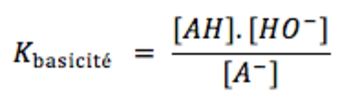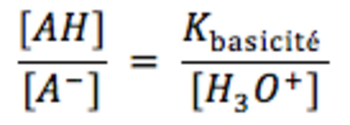-
Par lafandemusic1994 le 14 Août 2014 à 18:33
Thermodynamique<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Description d’un système thermodynamique<o:p></o:p>
<o:p> </o:p>
A) Trois types de système<o:p></o:p>
- Ouvert : échange énergie et matière avec le milieu extérieur.<o:p></o:p>
- Fermé : échange seulement de l’énergie avec le milieu extérieur.<o:p></o:p>
- Isolé : n’échange ni énergie, ni matière avec le milieu extérieur.<o:p></o:p>
→ Par convention, l’énergie reçue par le système est comptée positive et l’énergie cédée est comptée négative.<o:p></o:p>
<o:p> </o:p>
B) Variable d’état<o:p></o:p>
- Elle est mesurable et est caractéristique d’un état du système, il en existe deux types :<o:p></o:p>
ü variables extensives → proportionnelles à la quantité globale de matière du système (m, V…)<o:p></o:p>
ü variables intensives → indépendantes de la quantité globale de matière du système (P, T…)<o:p></o:p>
- Equation d’état → relation reliant plusieurs variables d’état (ex : PV=nRT).<o:p></o:p>
<o:p> </o:p>
C) Fonction d’état<o:p></o:p>
- Grandeur extensive qui ne dépend QUE des variables d’état.<o:p></o:p>
- Ne dépend que de l’état initial et final du système : ΔX = Xf - Xi.<o:p></o:p>
<o:p> </o:p>
D) Différents types de transformation<o:p></o:p>
- Transformation isotherme → à T constant.<o:p></o:p>
- Transformation isobare → à P constante.<o:p></o:p>
- Transformation isochore → à V constant.<o:p></o:p>
- Transformation adiabatique → aucun échange de chaleur avec le milieu extérieur.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
II) Etat standard<o:p></o:p>
<o:p> </o:p>
- à chaque état de la matière, existe un état de référence.<o:p></o:p>
- Pour un corps ou constituant, l’état standard correspond à l’état physique du constituant à pression et température donnée.<o:p></o:p>
→ A 125°C, l’état standard de ref de l’eau est H2O(g) alors qu’à -5°C c’est H2O(s).<o:p></o:p>
<o:p> </o:p>
- Exceptions :<o:p></o:p>
Type d’élément<o:p></o:p>
Etat standard de ref à toute température (sous 1bar)<o:p></o:p>
Tout élément (≠gaz rare) <o:p></o:p>
Gaz parfait diatomique (H2, N2, F2...)<o:p></o:p>
Carbone<o:p></o:p>
Carbone graphite C(s)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
III) Premier principe : l’énergie se conserve, elle ne peut être ni créée, ni détruite.<o:p></o:p>
A) Energie interne U (échange d’énergie sous forme de chaleur)<o:p></o:p>
- Grandeur extensive (fonction d’état) exprimée en J ou en cal (1cal = 4.18J) : ΔU = W + Q.<o:p></o:p>
- Transformation isochore : ΔU = Qv.<o:p></o:p>
<o:p> </o:p>
B) Enthalpie H [J] (chaleur échangée au cours de la transformation)<o:p></o:p>
- Fonction d’état plus adaptée car les réactions ont le plus souvent lieu à P constante : H = U + PV.<o:p></o:p>
- Transformation isobare : ΔH = Qp.<o:p></o:p>
<o:p> </o:p>
C) Relation entre ΔU et ΔH<o:p></o:p>
- ΔH = ΔU + ΔPV(g) ou ΔH = ΔU + RTΔngaz<o:p></o:p>
<o:p> </o:p>
D) Echange de chaleur lors d’une variation de température pour un corps pur<o:p></o:p>
- Les capacités calorifiques massiques [J/kg.K] (molaires [J/mol.K]) désignent les quantités de chaleur nécessaires à apporter à un kg (une mole) d’un corps pur à P ou V contant afin d’augmenter sa température de 1K = 1°C.<o:p></o:p>
- Transformation isobare : Qp = m.cp. ΔT = n.Cp.ΔT<o:p></o:p>
- Transformation isochore : Qv = m.cv. ΔT = n.Cv.ΔT<o:p></o:p>
- Pour un gaz parfait → ΔH = n.Cp. ΔT, et ΔU = n.Cv. ΔT<o:p></o:p>
- Pour les phases condensées (liquides ou solides), Cp= Cv → ΔH = ΔU = n.Cp.ΔT<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
IV) Thermochimie<o:p></o:p>
<o:p> </o:p>
A) Grandeur standard de réaction<o:p></o:p>
Sous une pression de 1bar : ΔrH°(T) = ΔrU°(T) + RTΔrvgaz [J/mol]<o:p></o:p>
<o:p> </o:p>
B) Chaleur de réaction isotherme Qr<o:p></o:p>
- C’est la quantité de chaleur reçue ou cédée par un système au cours d’un avancement de la réaction à une température T.<o:p></o:p>
- A pression standard constante, on a Qr = ΔrH° et la réaction peut être :<o:p></o:p>
ü endothermique si ΔrH° > 0 → absorption de chaleur.<o:p></o:p>
ü exothermique si ΔrH° < 0 → cède de la chaleur.<o:p></o:p>
ü athermique si ΔrH° = 0 → n’échange pas de chaleur.<o:p></o:p>
<o:p> </o:p>
C) Lois de Kirchoff<o:p></o:p>
ΔrH°(T2) = ΔrH°(T1) + ΔrCp° (T2-T1) // ΔrU°(T2) = ΔrU°(T1) + ΔrCv° (T2-T1)<o:p></o:p>
<o:p> </o:p>
V) Détermination des enthalpies standard de réaction ΔrH°<o:p></o:p>
<o:p> </o:p>
A) Cycle thermodynamique<o:p></o:p>
- Loi de Hess : ΔrH° ne dépend que de l’état initial et de l’état final du système.<o:p></o:p>
- Cycle thermodynamique :<o:p></o:p>
/!\ Lors de l’addition des différents termes, <o:p></o:p>
le sens des flèches de chacune des étapes conditionne le signe de ΔrH° /!\
<o:p></o:p>B) Enthalpie standard de formation ΔfH°<o:p></o:p>
- L’enthalpie standard de formation d’un corps simple pris dans son état de référence est nulle.<o:p></o:p>
- ΔrH° = Σ(vi. ΔfHi°), vi <0 pour les réactifs et >0 pour les produits.<o:p></o:p>
<o:p> </o:p>
C) Energies de liaison [kJ/mol]<o:p></o:p>
- L’énergie de liaison d’une molécule diatomique AB, notée DA-B, correspond à la réaction au cours de laquelle une mole de AB à l’état gazeux est dissociée, à 0k, en deux radicaux à l’état gazeux.<o:p></o:p>
- DA-B = ΔrH°(T).<o:p></o:p>
<o:p> </o:p>
VI) Changement d’état<o:p></o:p>
<o:p> </o:p>
A) Diagramme de phase<o:p></o:p>
- Représentation en 2D où figurent les domaines de stabilité des trois états de l’espèce (solide, liquide, gaz).<o:p></o:p>
- Point double/triple : endroit où les phases coexistent à l’équilibre.<o:p></o:p>
<o:p> </o:p>
B) Enthalpie standard de changement d’état<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
Ex : ΔsubH° = ΔfusH° + ΔvapH°
<o:p></o:p><o:p> </o:p>
VII) Second principe : principe d’évolution permettant de déterminer la spontanéité d’une réaction<o:p></o:p>
<o:p> </o:p>
A) Entropie S (relié à la notion d’ordre)<o:p></o:p>
- Fonction d’état extensive.<o:p></o:p>
ü Réaction réversible : ΔSrev = SB-SA → système isolé : ΔS = 0 (équilibre) et ΔS > 0 (spontanée).<o:p></o:p>
ü Réaction irréversible et système isolé : l’entropie augmente.<o:p></o:p>
- L’entropie de l’univers augmente continuellement.<o:p></o:p>
<o:p> </o:p>
B) Variation de l’enthalpie libre G<o:p></o:p>
- A, P et T constants : G = H - TS <o:p></o:p>
- A, T et V constants : F = U - TS <o:p></o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire
-
Par lafandemusic1994 le 14 Août 2014 à 18:31
Equilibres chimiques<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Définition de l’équilibre chimique<o:p></o:p>
<o:p> </o:p>
- Un système chimique atteint un état d’équilibre lorsque sa composition ne varie plus.<o:p></o:p>
→ Le système n’est pas figé : les vitesses des réactions dans les sens direct et indirect sont identiques.<o:p></o:p>
<o:p> </o:p>
II) Description de l’état d’un système<o:p></o:p>
<o:p> </o:p>
A) Quotient réactionnel Q = produit des aivi<o:p></o:p>
Ex : 2 NO(g) + O2(g) = 2 NO2(g)<o:p></o:p>
→ Q = aNO-2. aO2-1. aNO22<o:p></o:p>
<o:p> </o:p>
B) Constante d’équilibre K = Qéquil = produit des aivi, équil<o:p></o:p>
ΔrG° = -RT.ln(K) → K = e- ΔrG°/RT<o:p></o:p>
<o:p> </o:p>
C) Température d’inversion T<o:p></o:p>
- Température pour laquelle a lieu un changement de sens de la réaction : une réaction favorisée dans le sens direct peut être rendue spontanée dans le sens indirect.<o:p></o:p>
- A cette température, on a : K=1 et ΔrG°=0.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
III) Expressions de l’activité<o:p></o:p>
<o:p> </o:p>
A) Cas des équilibres homogènes gazeux<o:p></o:p>
- Pour un gaz parfait, l’activité d’un constituant est : ai = pi/P°<o:p></o:p>
Avec pi : pression partielle du constituant i et P° : pression standard (1bar).<o:p></o:p>
<o:p> </o:p>
B) Cas des équilibres homogènes liquides<o:p></o:p>
- L’activité d’un soluté est : ai = Ci/C°<o:p></o:p>
Avec Ci : concentration du constituant i à l’équilibre et C° : concentration de référence (1mol/L).<o:p></o:p>
<o:p> </o:p>
C) Cas des équilibres hétérogènes<o:p></o:p>
- L’activité d’un corps solide est égale à 1, comme pour les solvants (aH2O=1).<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
IV) Sens d’évolution d’un système<o:p></o:p>
<o:p> </o:p>
L’avancement correspond au nombre de mole de réactifs consommé à l’instant t :<o:p></o:p>
ξ = (nl – n0) / v<o:p></o:p>
Avec v le coefficient stoechiométrique (< 0 pour les réactifs et > 0 pour les produits)<o:p></o:p>
<o:p> </o:p>
- Si, à l’état initial, il n’y a que des réactifs → sens direct.<o:p></o:p>
- Si, à l’état initial, il y a des réactifs et des produits, alors :<o:p></o:p>
ü si Qi < K → la réaction évolue dans le sens direct 1.<o:p></o:p>
ü si Qi > K → la réaction évolue dans le sens indirect 2.<o:p></o:p>
ü si Qi = K → le système est à l’équilibre et n’évolue pas.<o:p></o:p>
<o:p> </o:p>
V) Influence des conditions opératoires sur l’équilibre<o:p></o:p>
Loi de Le Chatelier : quand un système à l’équilibre est soumis à une perturbation, il évolue dans le sens qui tend à s’opposer à l’effet de cette perturbation.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Influence de la pression<o:p></o:p>
Seulement pour les systèmes constitués d’une ou plusieurs espèces gazeuses.<o:p></o:p>
→ Si on augmente la pression, l’équilibre se déplacera dans le sens direct 1.<o:p></o:p>
<o:p> </o:p>
B) Influence de la température<o:p></o:p>
- Pour une réaction exothermique : une élévation de la T° déplace la réaction dans le sens de formation des réactifs.<o:p></o:p>
→ ΔrH° <0 + ΔT >0 = Sens indirect.<o:p></o:p>
- Pour une réaction endothermique : une élévation de la T° déplace la réaction dans le sens de formation des produits.<o:p></o:p>
→ ΔrH° >0 + ΔT >0 = Sens direct.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
- Relation de Van’t Hoff :<o:p></o:p>
<o:p></o:p>
<v:shapetype coordsize="21600,21600" filled="f" id="_x0000_t75" o:preferrelative="t" o:spt="75" path="m@4@5l@4@11@9@11@9@5xe" stroked="f"> <v:stroke joinstyle="miter"> <v:formulas> <v:f eqn="if lineDrawn pixelLineWidth 0"> <v:f eqn="sum @0 1 0"> <v:f eqn="sum 0 0 @1"> <v:f eqn="prod @2 1 2"> <v:f eqn="prod @3 21600 pixelWidth"> <v:f eqn="prod @3 21600 pixelHeight"> <v:f eqn="sum @0 0 1"> <v:f eqn="prod @6 1 2"> <v:f eqn="prod @7 21600 pixelWidth"> <v:f eqn="sum @8 21600 0"> <v:f eqn="prod @7 21600 pixelHeight"> <v:f eqn="sum @10 21600 0"> </v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:f></v:formulas> <v:path gradientshapeok="t" o:connecttype="rect" o:extrusionok="f"> <o:lock aspectratio="t" v:ext="edit"> </o:lock></v:path></v:stroke></v:shapetype><v:shape id="Image_x0020_5" o:spid="_x0000_i1026" style="width:175pt;height:40pt;visibility:visible;mso-wrap-style:square" type="#_x0000_t75"> <v:imagedata o:title="" src="file://localhost/Users/Leana/Library/Caches/TemporaryItems/msoclip/0/clip_image001.png"> </v:imagedata></v:shape> ó <v:shape id="Image_x0020_6" o:spid="_x0000_i1025" style="width:151pt;height:48pt;visibility:visible;mso-wrap-style:square" type="#_x0000_t75"> <v:imagedata o:title="" src="file://localhost/Users/Leana/Library/Caches/TemporaryItems/msoclip/0/clip_image002.png"> </v:imagedata></v:shape><o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
C) Influence de l’ajout d’un constituant actif à T et V constants<o:p></o:p>
<o:p> </o:p>
- Si le constituant actif est un solide ou un liquide pur, alors l’ajout de ce constituant n’aura aucun effet sur l’état d’équilibre du système.<o:p></o:p>
<o:p> </o:p>
- Si le constituant actif est gazeux, alors l’ajout de ce constituant déplacera l’équilibre dans le sens où l’espèce introduite est consommée.<o:p></o:p>
 votre commentaire
votre commentaire
-
Par lafandemusic1994 le 14 Août 2014 à 18:30
Equilibres acide-base<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Notion acide-base<o:p></o:p>
- Un (poly)acide peut céder un (plusieurs) proton H+ → AH = A- + H+<o:p></o:p>
- Une (poly)base peut capter un (plusieurs) proton H+ → BH+ = B + H+<o:p></o:p>
→ Les couples AH/A- et BH+/B sont des couples acide-base conjugués<o:p></o:p>
- Ampholyte (= espèce amphotère) : espèce pouvant se comporter comme un acide ou une base (H2O).<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
II) Réaction acide-base<o:p></o:p>
- Acide 1 + Base 2 = Base 1 + Acide 2<o:p></o:p>
- Autoprotolyse de l’eau : 2 H2O = H3O+ + OH-<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
III) Force des acides<o:p></o:p>
<o:p> </o:p>
A) Acides forts/Bases fortes<o:p></o:p>
- Espèces qui réagissent totalement avec l’eau → Nivellement par le solvant eau car l’eau ne pourra pas différencier les couples dont le pKA n’est pas compris entre 0 et 14.<o:p></o:p>
Ø Acides forts → KA positif (très grand) et pKA négatif (<0)<o:p></o:p>
Ø Bases fortes → KA positif (très petit) et pKA positif (>14)<o:p></o:p>
<o:p> </o:p>
B) Acides faibles/Bases faibles<o:p></o:p>
- Espèces qui réagissent partiellement avec l’eau → pas de nivellement car l’eau pourra les différencier.<o:p></o:p>
- Plus le KA est élevé (= pKA est bas), plus l’acide aura tendance à se comporter comme un acide fort (et inversement pour les bases).<o:p></o:p>
<o:p> </o:p>
C) Constantes d’acidité KA /Basicité KB /Equilibre Ke<o:p></o:p>
- Ke = [H3O+] x [OH-] = 10-14, à 25°C ó pKe = -log Ke = 14.<o:p></o:p>
- pKB = pKe - pKA = 14 - pKA<o:p></o:p>
- pKA = pKe - pKB = 14 - pKB<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
IV) pH<o:p></o:p>
pH = -log [H3O+]<o:p></o:p>
Ø [H3O+] = [OH-] → solution neutre (pH = 7).<o:p></o:p>
Ø [H3O+] > [OH-] → solution acide (pH < 7).<o:p></o:p>
Ø [H3O+] < [OH-] → solution basique (pH > 7).<o:p></o:p>
<o:p> </o:p>
- AH prédomine devant A- si [AH] > [A-] = pH < pKA → inversement pour A- lorsqu’il prédomine devant AH.<o:p></o:p>
- AH majoritaire devant A- si [AH] > 10[A-] = pH < pKA -1 → [A-] est alors négligeable.<o:p></o:p>
- A- majoritaire devant AH si [A-] > 10[AH] = pH > pKA +1 → [AH] est alors négligeable.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
V) Mesure du pH<o:p></o:p>
<o:p> </o:p>
- Papier pH : bandelette imbibée d’un indicateur coloré universel, qui change de couleur graduellement en fonction du pH du milieu → Mesure simple et rapide mais imprécise.<o:p></o:p>
<o:p> </o:p>
- pH-mètre : boitier électronique relié à une électrode de référence et une électrode de mesure → Mesure précise mais moins rapide, à condition que le pH-mètre ait été étalonné à l’aide des solutions tampons.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VI) Calcul du pH<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Monoacides et monobases<o:p></o:p>
Acide fort → pH = -log [H3O+] = -log CA<o:p></o:p>
Base forte → pH = 14 + log CB<o:p></o:p>
<o:p> </o:p>
Acide faible ([H3O+] = h)<o:p></o:p>
Ø Peu dissocié (KA <10-3 = pKA >3) → pH = 1/2 (pKA - log CA) OU h = √KA.CA<o:p></o:p>
Le pH doit être inférieur à pKA-1 car on a supposé AH majoritaire<o:p></o:p>
Ø Moyennement dissocié (KA >10-3 = pKA <3) → h² + KA.h - KA.CA = 0, avec pH = -log h<o:p></o:p>
<o:p> </o:p>
Base faible ([OH-] = w)<o:p></o:p>
Ø Peu protonée (KB < 10-3 = KA >10-11 = pKA < 11) → pH = 7 + 1/2 (pKA + log CB)<o:p></o:p>
Le pH doit être supérieur à pKA+1 car on a supposé A- majoritaire<o:p></o:p>
Ø Moyennement protonée (KB > 10-3 = pKA > 11) → w² + (Ke/KA).w (Ke/KA).CB = 0<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Polyacides et polybases<o:p></o:p>
ΔpKA > 2 : on utilisera l’acidité la plus forte pour fixer le pH → pH = 1/2 (pKA1 - log C)<o:p></o:p>
Même chose pour les polybases si ΔpKA > 2, on utilise la plus forte → pH = 7 + 1/2 (pKA1 + log C)<o:p></o:p>
ΔpKA < 2 → HORS PROGRAMME<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
D) Ampholyte<o:p></o:p>
En solution, il est impliqué dans 3 équilibres différents → le pH sera donnée par la réaction avec le plus grand KA, on aura donc 2 couples acide/base conjugués → pH = 1/2 (pKA1 + pKA2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
E) Mélange d’acides<o:p></o:p>
ΔpKA > 2, avec concentrations des acides du même ordre : l’acide le plus fort impose le pH → pH = 1/2 (pKA1 - log C)<o:p></o:p>
ΔpKA < 2 : on prend en compte toutes les acidités → pH = -1/2 log (KA1.C1 + KA2.C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
F) Mélange de bases<o:p></o:p>
ΔpKA > 2, avec concentrations des différentes bases du même ordre → pH = 7 + 1/2 (pKA1 + log C)<o:p></o:p>
ΔpKA < 2 : on prend en compte toutes les basicités → pH = 14 + 1/2 log (KA1.C1 + KA2.C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
G) Mélange d’un acide faible et de sa base conjuguée<o:p></o:p>
→ pH = pKA + log (CB/CA)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
H) Mélange d’un acide faible et de sa base non conjuguée<o:p></o:p>
ΔpKA > 3 → pH = 1/2 (pKA1 + pKA2) + 1/2 log (C2/C1)<o:p></o:p>
Si C1=C2, on obtient la formule du pH d’un ampholyte.<o:p></o:p>
<o:p> </o:p>
ΔpKA < 3 → résolution d’une équation du second degré : K = x² / (C1-x). (C2-x)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
VII) Titrage acido-basique<o:p></o:p>
<o:p> </o:p>
A) Principe<o:p></o:p>
- Permet de déterminer la quantité d’une espèce chimique présente dans un échantillon.<o:p></o:p>
- A l’équivalence, les réactifs auront été introduits dans les proportions stoechiométriques et on aura VB = Veq :<o:p></o:p>
→ CA VA = CB VB ó CA VA = CB Veq<o:p></o:p>
- Une réaction de titrage doit être quantitative, unique et rapide.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Comparaison des courbes acide faible/acide fort<o:p></o:p>
<o:p> </o:p>
Acide faible<o:p></o:p>
Acide fort<o:p></o:p>
Remarque<o:p></o:p>
Saut de pH<o:p></o:p>
Peu important<o:p></o:p>
Très important<o:p></o:p>
≠ d’autant plus marquée que pKA est grand<o:p></o:p>
Points d’inflexions<o:p></o:p>
2 : demi-équivalence (avec pH=pKA) et équivalence<o:p></o:p>
1 à l’équivalence<o:p></o:p>
Point d’inflexion = changement de concavité de la courbe)<o:p></o:p>
Evolution du pH<o:p></o:p>
Irrégulière<o:p></o:p>
Régulière<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
VIII) Solution tampon<o:p></o:p>
- Solution dont le pH varie peu par addition modérée d’acide ou de base, ou par dilution modérée (ajout d’eau).<o:p></o:p>
- Préparation de différentes façons :<o:p></o:p>
Ø Mélanger un acide faible et sa base conjuguée en quantités égales.<o:p></o:p>
Ø Rajouter un acide fort (base forte) dans une solution de base faible (acide faible) jusqu’à la demi-équivalence<o:p></o:p>
<o:p> </o:p>
- Plus la variation de pH est faible lors de l’ajout d’un acide ou d’une base forte, plus l’effet tampon est important.<o:p></o:p>
- Limites extrêmes de pH compatibles avec la vie : pH = 6.8 (acidose grave) et pH = 7.8 (alcalose grave).<o:p></o:p>
<o:p> </o:p>
- 2 systèmes régulateurs : reins et poumons.<o:p></o:p>
- 2 types de tampons :<o:p></o:p>
Ø Fermés → [AH] + [A-] constant (ex : tampon phosphorique H2PO4-/HPO4- et tampon protéique).<o:p></o:p>
Ø Ouverts → [AH] + [A-] inconstant (ex : tampon bicarbonate CO2, H2O/HCO3-).<o:p></o:p>
 votre commentaire
votre commentaire
-
Par lafandemusic1994 le 14 Août 2014 à 18:25
Les couples acides bases<o:p></o:p>
<o:p> </o:p>
I) Définition <o:p></o:p>
Acide : molécule qui cède une ou x protons H+<o:p></o:p>
Monoacide (perd un proton) : NH4+ / H2O<o:p></o:p>
Polyacide (perd plusieurs protons) : H3PO4<o:p></o:p>
<o:p> </o:p>
Base : molécule capter un ou x proton H+<o:p></o:p>
Monobase (capte un proton) : HO- / NH3<o:p></o:p>
Polybase (capte plusieurs protons) : CO32-<o:p></o:p>
<o:p> </o:p>
Quand équilibre chimique on a = ou ó<o:p></o:p>
Quand la réaction est totale on a à<o:p></o:p>
<o:p> </o:p>
II) Les réactions acide / base<o:p></o:p>
Les réactions chimiques sont associées à un équilibre chimique. L’équilibre chimique est associé à des réactifs et à des produits.<o:p></o:p>
Les réactions acide base sont la somme des deux demi réactions :<o:p></o:p>
AH = A- + H+ <o:p></o:p>
B- + H+ = BH<o:p></o:p>
<o:p> </o:p>
Un acide et une base peuvent donc réagir ensemble :<o:p></o:p>
AH + B- = BH + A-<o:p></o:p>
<o:p> </o:p>
1) L’autoprotolyse de l’eau<o:p></o:p>
L’eau est une molécule particulière qui peut à la fois agir comme base et comme acide on a donc ce que l’on appelle l’autoprotolyse de l’eau<o:p></o:p>
2 H2O = H3O+ + HO-<o:p></o:p>
<o:p> </o:p>
Les réactions chimiques sont liées à une constante d’équilibre<o:p></o:p>
Keau = [H30+].[HO-] = 10-14 à condition normales de température et pression <o:p></o:p>
<o:p> </o:p>
2) Fort / Faible<o:p></o:p>
Ces réactions sont équilibrées et elle peut plus ou moins être décalé. Être fort ou faible <o:p></o:p>
<o:p> </o:p>
a) Acide fort<o:p></o:p>
Acide fort : réagit totalement avec l’eau qui joue le rôle de base<o:p></o:p>
AH + H2O à A- + H3O+<o:p></o:p>
<o:p> </o:p>
b) Base forte<o:p></o:p>
Base forte : réagit totalement avec l’eau qui joue le rôle d’acide<o:p></o:p>
A- + H2O à AH + HO-<o:p></o:p>
<o:p> </o:p>
Ces base et acide fort ‘’n’ont pas’’ de constante d’équilibre normale (elles peuvent donc être très négatives è tend vers l’infini)<o:p></o:p>
<o:p> </o:p>
c) Acide faible<o:p></o:p>
Acide faible : réagissent que partiellement avec l’eau (elle est donc équilibré) :<o:p></o:p>
AH + H2O = A- + H3O+<o:p></o:p>
La constante d’acidité est une constante d’équilibre lié à un acide (produit des concentrations des produits diviser par les concentrations des réactions sans H20) : <o:p></o:p>
d) Base faible<o:p></o:p>
Même chose pour la constante de basicité Base faible <o:p></o:p>
A- + H2O = AH + HO-<o:p></o:p>
<o:p> </o:p>
3) Acides et bases conjuguées<o:p></o:p>
On remarque que Kbasicité = Keau / Kacidité<o:p></o:p>
La connaissance de Kbasicité implique celle de Kacidité pour un couple acide base<o:p></o:p>
Kacidité est égale à une valeur numérique, c’est un indicateur de la force d’un acide ou d’une base en solution aqueuse<o:p></o:p>
On emploie aussi le pKacidité = -log Kacidité qui est plus simple à manipuler.<o:p></o:p>
Plus le pKacidité est petit plus l’acide de ce couple est fort (et inversement)<o:p></o:p>
<o:p> </o:p>
III) Le pH<o:p></o:p>
Le pH est un nombre qui donne la quantité de proton libre dans une solution <o:p></o:p>
pH = -log [H3O+]<o:p></o:p>
<o:p> </o:p>
Si [H3O+] = [HO-] è la solution est neutre è 10-7 mol.L-1 è ph 7<o:p></o:p>
Si [H3O+] < [HO-] è la solution est basique<o:p></o:p>
Si [H3O+] > [HO-] è la solution est acide<o:p></o:p>
<o:p> </o:p>
Le pH est une grandeur physico chimique de référence, elle est contrôle et contrôlable. Le pH est utilisé dans les approches biomédicales, certains pH doivent être tamponnés (7,35 < pH sang < 7,45 et 7,9 < pH liquide céphalo rachidien < 8,1)<o:p></o:p>
<o:p> </o:p>
1) Prédominance des espèces<o:p></o:p>
La prédominance d’une espèce A sur B est quand la concentration de l’une par rapport à l’autre.<o:p></o:p>
On compare donc les concentrations A et AH<o:p></o:p>
<o:p> </o:p>
On en déduit que AH prédomine sur A si [AH] > [A-] soit pH < pKacidité<o:p></o:p>
On en déduit que A- prédomine sur AH si [A-] > [AH] soit pH > pKacidité<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
2) Espèce majoritaire :<o:p></o:p>
Une espèce est majoritaire quand [A] > 10 [B]<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
AH est majoritaire devant A- lorsque [AH] > 10 [A-] soit pH < pKacidité – 1 (on peut négliger [A-] devant [AH])<o:p></o:p>
A- est majoritaire devant AH lorsque [A-] > 10 [AH] soit pH > pKacidité + 1 (on peut négliger [AH] devant [A-])<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
IV) La mesure du pH :<o:p></o:p>
Il existe plusieurs types de mesure du pH<o:p></o:p>
- Le papier pH (environ une unité de pH) c’est simple et rapide. La bandelette change de couleur suivant le pH<o:p></o:p>
- Le pH-mètre (entre 0,01 unité de pH) précis mais long car il doit être étalonner au préalable. Les électrodes envoient du courant dans la solution en fonction de la concentration en ion H+<o:p></o:p>
La différence de potentiel est donc proportionnelle à la concentration en ion H+ ou au pH.<o:p></o:p>
ΔE = a.(pH) + b<o:p></o:p>
<o:p> </o:p>
V) Calcul du pH<o:p></o:p>
1) acide / base forte<o:p></o:p>
tableau d’avancement<o:p></o:p>
pH = -log [H3O+] = - log Cacide<o:p></o:p>
pH = 14 + log Cbasicité (pour la base forte)<o:p></o:p>
<o:p> </o:p>
2) acide faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
Ka = h2 / (Ca –h)<o:p></o:p>
Si constante d’acidité est très petite (K < 10-3 ou pKacidité >3) è AH est très faiblement dissocié : [A-] << [AH] è h est négligeable devant Ca<o:p></o:p>
On peut écrire Ka = h2 / Cacidité<o:p></o:p>
pH = ½ (pKacidité – log Cacidité)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (K > 10-3 ou pKacidité < 3) è ne peut pas négliger h devant Ca<o:p></o:p>
h2 + Ka .h – Ka . Ca = 0<o:p></o:p>
<o:p> </o:p>
3) Base faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
K = ([AH].[HO-])/[A-] = ω2 / Cb- ω = Ke/ Ka<o:p></o:p>
<o:p> </o:p>
Si constante de basicité est très petite (Kb < 10-3 ou Ka > 10-11) è A- est très faiblement protoné: [AH] << [A-] è w est négligeable devant Cb<o:p></o:p>
On peut écrire Ka = ω2 / Cb = Ke / Ka<o:p></o:p>
pH = 7 + ½ (pKacidité + log Ca)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (Kb > 10-3 ou Kacidité < 10-11) è A- n’est plus très faiblement protoné <o:p></o:p>
ω2 + Ke/pKacidité .ω – Ke/pKacidité . Cb = 0<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VI) Polyacide <o:p></o:p>
Un polyacide est un mélange de deux acides, ils peuvent donc céder plusieurs protons.<o:p></o:p>
Si ΔpKacidité > 2, c’est la première acidité fixera le ph, on calcule du pH d’un monoacide faible<o:p></o:p>
pH = ½ (pKacidité – log Ca)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VII) Ampholyte<o:p></o:p>
Un ampholyte est un composé qui joue le rôle de base et d’acide.<o:p></o:p>
Quand on cherche le pH d’un ampholyte ça revient à faire le mélange de deux couple acide / base. Ce composé aura deux constantes d’acidité Ka1 et Ka2<o:p></o:p>
(1) AH- + AH- = AH2 + A2- è K1<o:p></o:p>
(2) AH- + H2O = AH2 + HO- è K2<o:p></o:p>
(3) AH- + H2O = A2- + H3O+ è K3<o:p></o:p>
<o:p> </o:p>
Cas particulier : 1 est prépondérante c’est à dire qu’il y a un équilibre entre l’acide et la base, les constantes d’équilibre entre (2) et (3) deviennent négligeables.<o:p></o:p>
K1 > 10^3 K2 <o:p></o:p>
K1 > 10^3 K3<o:p></o:p>
<o:p> </o:p>
Si (1) prépondérante <o:p></o:p>
Tableau d’avancement<o:p></o:p>
Ka1 . Ka2 = [H30+]2<o:p></o:p>
pH = ½ (pKa1 + pKa2)<o:p></o:p>
<o:p> </o:p>
VIII)Mélange de deux solutions<o:p></o:p>
Mélange de deux acides en quantités équivalentes peuvent être de plusieurs natures différentes<o:p></o:p>
1er cas : 2 acides forts pH = - log (C1 + C2)<o:p></o:p>
2ème cas : 1 acide fort avec 1 acide faible. L’acide fort est prépondérant pH = - log Cfort<o:p></o:p>
3ème cas : 2 acides faibles <o:p></o:p>
ΔpKa > 2 è le pH est dicté par l’acide le plus fort (pKa le plus petit) è pH = ½ (pK1 - log Ca)<o:p></o:p>
ΔpKa < 2 è pH = -1/2 log (Ka1 . C1 + KA2 + C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Mélange acide base conjuguée (solution tampon)<o:p></o:p>
pH = pKa + log [Cb]/[Ca]<o:p></o:p>
<o:p> </o:p>
B) Mélange acide base non conjuguée<o:p></o:p>
Tableau d’avancement<o:p></o:p>
K = KA1 / KA2<o:p></o:p>
<o:p> </o:p>
Si K < 10^-3, soit pKa > 3<o:p></o:p>
pH = ½ (pKA1 + pKA2) + ½ log (C2/C1)<o:p></o:p>
Si C1 = C2 è pH = ½ (pKA1 + pKA2)<o:p></o:p>
<o:p> </o:p>
Si K > 10^-3, soit pKa < 3, il faudra résoudre<o:p></o:p>
K = x^2 / (C1-x).(C2-x)<o:p></o:p>
<o:p> </o:p>
IX) Les titrages acido-basiques<o:p></o:p>
J’ai une solution connue et une solution inconnue je verse goutte à goutte la solution connue dans la solution inconnue jusqu’à un changement de couleur ou jusqu’à obtenir une courbe en S (avec le point équivalent)<o:p></o:p>
<o:p> </o:p>
A) Acide fort titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide fort et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
Quand on verse autant de moles de base que d’acide on obtient le point équivalent. On dit que l’acide et la base ont été mélangés dans des proportions stoechiométriques.<o:p></o:p>
ninitial = najouté<o:p></o:p>
ó Ca . Va = Cb . Vb<o:p></o:p>
<o:p> </o:p>
1) Courbe de titrage <o:p></o:p>
Elle représente l’évolution du pH en fonction du volume de base versée.<o:p></o:p>
Schéma<o:p></o:p>
Avant point équivalent pH acide <o:p></o:p>
Après point équivalent pH basique<o:p></o:p>
<o:p> </o:p>
2) Point équivalent (d’un point de vue graphique)<o:p></o:p>
Méthode des tangentes<o:p></o:p>
Tangente bas / tangente parallèle haut è parallèle au milieu = point équivalent<o:p></o:p>
<o:p> </o:p>
3) pH à différents points de la courbe<o:p></o:p>
V=0 pH acide fort pH = -log [H3O+] = - log Ca<o:p></o:p>
0 < Vb < Veq pH = - log (Cb. (Veq – Vb)/(Vb + Va)<o:p></o:p>
Vb = Veq pH = 7<o:p></o:p>
Vb > Veq è pH = 14 + log (Cb. (Vb – Veq)/ (Vb+Va))<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Acide faible titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide faible et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
La courbe n’est plus symétrique, elle possède donc deux points d’intérêt : <o:p></o:p>
Le point équivalent (méthode des tangentes)<o:p></o:p>
Le point demi-équivalent qui correspond à pH = pKa<o:p></o:p>
<o:p> </o:p>
X) Solution tampon / pouvoir tampon<o:p></o:p>
Une solution tampon est une solution où le pH varie peu dans deux cas :<o:p></o:p>
Par addition d’un acide ou d’une base forte<o:p></o:p>
Par dilution modérée (eau)<o:p></o:p>
<o:p> </o:p>
Quand on fait un mélange équimolaire d’un acide faible et de sa base conjuguée, on se retrouve à la demi équivalence. C’est la meilleure solution pour créer une solution tampon<o:p></o:p>
<o:p> </o:p>
A) Préparation solution tampon<o:p></o:p>
1/ acide faible + base conjuguée en quantité égale<o:p></o:p>
2/ base faible + acide fort jusqu’à demi équivalence<o:p></o:p>
3/ acide faible + base forte jusqu’à demi équivalence<o:p></o:p>
<o:p> </o:p>
B) Solution tampon en biologie<o:p></o:p>
Le sang humain est tamponné à 7,4, il est régulé par deux couples H2PO4- / HPO42- et CO2 dissous / HCO3-<o:p></o:p>
<o:p> </o:p>
Si pH < 7,4 è acidose<o:p></o:p>
Si pH > 7,4 è alcalose (solution basique = solution alcaline)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Changement d’état <o:p></o:p>
Un corps peut se trouver sous 3 formes :<o:p></o:p>
- solide<o:p></o:p>
- liquide <o:p></o:p>
- gazeux<o:p></o:p>
<o:p> </o:p>
On peut représenter les transitions entre les différents états par un diagramme de phase.
<o:p> </o:p>
Pas de perte ou de création d’énergie<o:p></o:p>
L’énergie de solidification + l’énergie de sublimation = l’énergie de vaporisation <o:p></o:p>
 votre commentaire
votre commentaire
-
Par lafandemusic1994 le 14 Août 2014 à 18:24
Les couples acides bases<o:p></o:p>
<o:p> </o:p>
I) Définition <o:p></o:p>
Acide : molécule qui cède une ou x protons H+<o:p></o:p>
Monoacide (perd un proton) : NH4+ / H2O<o:p></o:p>
Polyacide (perd plusieurs protons) : H3PO4<o:p></o:p>
<o:p> </o:p>
Base : molécule capter un ou x proton H+<o:p></o:p>
Monobase (capte un proton) : HO- / NH3<o:p></o:p>
Polybase (capte plusieurs protons) : CO32-<o:p></o:p>
<o:p> </o:p>
Quand équilibre chimique on a = ou ó<o:p></o:p>
Quand la réaction est totale on a à<o:p></o:p>
<o:p> </o:p>
II) Les réactions acide / base<o:p></o:p>
Les réactions chimiques sont associées à un équilibre chimique. L’équilibre chimique est associé à des réactifs et à des produits.<o:p></o:p>
Les réactions acide base sont la somme des deux demi réactions :<o:p></o:p>
AH = A- + H+ <o:p></o:p>
B- + H+ = BH<o:p></o:p>
<o:p> </o:p>
Un acide et une base peuvent donc réagir ensemble :<o:p></o:p>
AH + B- = BH + A-<o:p></o:p>
<o:p> </o:p>
1) L’autoprotolyse de l’eau<o:p></o:p>
L’eau est une molécule particulière qui peut à la fois agir comme base et comme acide on a donc ce que l’on appelle l’autoprotolyse de l’eau<o:p></o:p>
2 H2O = H3O+ + HO-<o:p></o:p>
<o:p> </o:p>
Les réactions chimiques sont liées à une constante d’équilibre<o:p></o:p>
Keau = [H30+].[HO-] = 10-14 à condition normales de température et pression <o:p></o:p>
<o:p> </o:p>
2) Fort / Faible<o:p></o:p>
Ces réactions sont équilibrées et elle peut plus ou moins être décalé. Être fort ou faible <o:p></o:p>
<o:p> </o:p>
a) Acide fort<o:p></o:p>
Acide fort : réagit totalement avec l’eau qui joue le rôle de base<o:p></o:p>
AH + H2O à A- + H3O+<o:p></o:p>
<o:p> </o:p>
b) Base forte<o:p></o:p>
Base forte : réagit totalement avec l’eau qui joue le rôle d’acide<o:p></o:p>
A- + H2O à AH + HO-<o:p></o:p>
<o:p> </o:p>
Ces base et acide fort ‘’n’ont pas’’ de constante d’équilibre normale (elles peuvent donc être très négatives è tend vers l’infini)<o:p></o:p>
<o:p> </o:p>
c) Acide faible<o:p></o:p>
Acide faible : réagissent que partiellement avec l’eau (elle est donc équilibré) :<o:p></o:p>
AH + H2O = A- + H3O+<o:p></o:p>
La constante d’acidité est une constante d’équilibre lié à un acide (produit des concentrations des produits diviser par les concentrations des réactions sans H20) : <o:p></o:p>
d) Base faible<o:p></o:p>
Même chose pour la constante de basicité Base faible <o:p></o:p>
A- + H2O = AH + HO-<o:p></o:p>
<o:p> </o:p>
3) Acides et bases conjuguées<o:p></o:p>
On remarque que Kbasicité = Keau / Kacidité<o:p></o:p>
La connaissance de Kbasicité implique celle de Kacidité pour un couple acide base<o:p></o:p>
Kacidité est égale à une valeur numérique, c’est un indicateur de la force d’un acide ou d’une base en solution aqueuse<o:p></o:p>
On emploie aussi le pKacidité = -log Kacidité qui est plus simple à manipuler.<o:p></o:p>
Plus le pKacidité est petit plus l’acide de ce couple est fort (et inversement)<o:p></o:p>
<o:p> </o:p>
III) Le pH<o:p></o:p>
Le pH est un nombre qui donne la quantité de proton libre dans une solution <o:p></o:p>
pH = -log [H3O+]<o:p></o:p>
<o:p> </o:p>
Si [H3O+] = [HO-] è la solution est neutre è 10-7 mol.L-1 è ph 7<o:p></o:p>
Si [H3O+] < [HO-] è la solution est basique<o:p></o:p>
Si [H3O+] > [HO-] è la solution est acide<o:p></o:p>
<o:p> </o:p>
Le pH est une grandeur physico chimique de référence, elle est contrôle et contrôlable. Le pH est utilisé dans les approches biomédicales, certains pH doivent être tamponnés (7,35 < pH sang < 7,45 et 7,9 < pH liquide céphalo rachidien < 8,1)<o:p></o:p>
<o:p> </o:p>
1) Prédominance des espèces<o:p></o:p>
La prédominance d’une espèce A sur B est quand la concentration de l’une par rapport à l’autre.<o:p></o:p>
On compare donc les concentrations A et AH<o:p></o:p>
<o:p> </o:p>
On en déduit que AH prédomine sur A si [AH] > [A-] soit pH < pKacidité<o:p></o:p>
On en déduit que A- prédomine sur AH si [A-] > [AH] soit pH > pKacidité<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
2) Espèce majoritaire :<o:p></o:p>
Une espèce est majoritaire quand [A] > 10 [B]<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
AH est majoritaire devant A- lorsque [AH] > 10 [A-] soit pH < pKacidité – 1 (on peut négliger [A-] devant [AH])<o:p></o:p>
A- est majoritaire devant AH lorsque [A-] > 10 [AH] soit pH > pKacidité + 1 (on peut négliger [AH] devant [A-])<o:p></o:p>
*diagramme de prédominance*<o:p></o:p>
<o:p> </o:p>
IV) La mesure du pH :<o:p></o:p>
Il existe plusieurs types de mesure du pH<o:p></o:p>
- Le papier pH (environ une unité de pH) c’est simple et rapide. La bandelette change de couleur suivant le pH<o:p></o:p>
- Le pH-mètre (entre 0,01 unité de pH) précis mais long car il doit être étalonner au préalable. Les électrodes envoient du courant dans la solution en fonction de la concentration en ion H+<o:p></o:p>
La différence de potentiel est donc proportionnelle à la concentration en ion H+ ou au pH.<o:p></o:p>
ΔE = a.(pH) + b<o:p></o:p>
<o:p> </o:p>
V) Calcul du pH<o:p></o:p>
1) acide / base forte<o:p></o:p>
tableau d’avancement<o:p></o:p>
pH = -log [H3O+] = - log Cacide<o:p></o:p>
pH = 14 + log Cbasicité (pour la base forte)<o:p></o:p>
<o:p> </o:p>
2) acide faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
Ka = h2 / (Ca –h)<o:p></o:p>
Si constante d’acidité est très petite (K < 10-3 ou pKacidité >3) è AH est très faiblement dissocié : [A-] << [AH] è h est négligeable devant Ca<o:p></o:p>
On peut écrire Ka = h2 / Cacidité<o:p></o:p>
pH = ½ (pKacidité – log Cacidité)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (K > 10-3 ou pKacidité < 3) è ne peut pas négliger h devant Ca<o:p></o:p>
h2 + Ka .h – Ka . Ca = 0<o:p></o:p>
<o:p> </o:p>
3) Base faible <o:p></o:p>
tableau d’avancement<o:p></o:p>
K = ([AH].[HO-])/[A-] = ω2 / Cb- ω = Ke/ Ka<o:p></o:p>
<o:p> </o:p>
Si constante de basicité est très petite (Kb < 10-3 ou Ka > 10-11) è A- est très faiblement protoné: [AH] << [A-] è w est négligeable devant Cb<o:p></o:p>
On peut écrire Ka = ω2 / Cb = Ke / Ka<o:p></o:p>
pH = 7 + ½ (pKacidité + log Ca)<o:p></o:p>
<o:p> </o:p>
Si constante d’acidité est très grand (Kb > 10-3 ou Kacidité < 10-11) è A- n’est plus très faiblement protoné <o:p></o:p>
ω2 + Ke/pKacidité .ω – Ke/pKacidité . Cb = 0<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VI) Polyacide <o:p></o:p>
Un polyacide est un mélange de deux acides, ils peuvent donc céder plusieurs protons.<o:p></o:p>
Si ΔpKacidité > 2, c’est la première acidité fixera le ph, on calcule du pH d’un monoacide faible<o:p></o:p>
pH = ½ (pKacidité – log Ca)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
VII) Ampholyte<o:p></o:p>
Un ampholyte est un composé qui joue le rôle de base et d’acide.<o:p></o:p>
Quand on cherche le pH d’un ampholyte ça revient à faire le mélange de deux couple acide / base. Ce composé aura deux constantes d’acidité Ka1 et Ka2<o:p></o:p>
(1) AH- + AH- = AH2 + A2- è K1<o:p></o:p>
(2) AH- + H2O = AH2 + HO- è K2<o:p></o:p>
(3) AH- + H2O = A2- + H3O+ è K3<o:p></o:p>
<o:p> </o:p>
Cas particulier : 1 est prépondérante c’est à dire qu’il y a un équilibre entre l’acide et la base, les constantes d’équilibre entre (2) et (3) deviennent négligeables.<o:p></o:p>
K1 > 10^3 K2 <o:p></o:p>
K1 > 10^3 K3<o:p></o:p>
<o:p> </o:p>
Si (1) prépondérante <o:p></o:p>
Tableau d’avancement<o:p></o:p>
Ka1 . Ka2 = [H30+]2<o:p></o:p>
pH = ½ (pKa1 + pKa2)<o:p></o:p>
<o:p> </o:p>
VIII)Mélange de deux solutions<o:p></o:p>
Mélange de deux acides en quantités équivalentes peuvent être de plusieurs natures différentes<o:p></o:p>
1er cas : 2 acides forts pH = - log (C1 + C2)<o:p></o:p>
2ème cas : 1 acide fort avec 1 acide faible. L’acide fort est prépondérant pH = - log Cfort<o:p></o:p>
3ème cas : 2 acides faibles <o:p></o:p>
ΔpKa > 2 è le pH est dicté par l’acide le plus fort (pKa le plus petit) è pH = ½ (pK1 - log Ca)<o:p></o:p>
ΔpKa < 2 è pH = -1/2 log (Ka1 . C1 + KA2 + C2)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
A) Mélange acide base conjuguée (solution tampon)<o:p></o:p>
pH = pKa + log [Cb]/[Ca]<o:p></o:p>
<o:p> </o:p>
B) Mélange acide base non conjuguée<o:p></o:p>
Tableau d’avancement<o:p></o:p>
K = KA1 / KA2<o:p></o:p>
<o:p> </o:p>
Si K < 10^-3, soit pKa > 3<o:p></o:p>
pH = ½ (pKA1 + pKA2) + ½ log (C2/C1)<o:p></o:p>
Si C1 = C2 è pH = ½ (pKA1 + pKA2)<o:p></o:p>
<o:p> </o:p>
Si K > 10^-3, soit pKa < 3, il faudra résoudre<o:p></o:p>
K = x^2 / (C1-x).(C2-x)<o:p></o:p>
<o:p> </o:p>
IX) Les titrages acido-basiques<o:p></o:p>
J’ai une solution connue et une solution inconnue je verse goutte à goutte la solution connue dans la solution inconnue jusqu’à un changement de couleur ou jusqu’à obtenir une courbe en S (avec le point équivalent)<o:p></o:p>
<o:p> </o:p>
A) Acide fort titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide fort et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
Quand on verse autant de moles de base que d’acide on obtient le point équivalent. On dit que l’acide et la base ont été mélangés dans des proportions stoechiométriques.<o:p></o:p>
ninitial = najouté<o:p></o:p>
ó Ca . Va = Cb . Vb<o:p></o:p>
<o:p> </o:p>
1) Courbe de titrage <o:p></o:p>
Elle représente l’évolution du pH en fonction du volume de base versée.<o:p></o:p>
Schéma<o:p></o:p>
Avant point équivalent pH acide <o:p></o:p>
Après point équivalent pH basique<o:p></o:p>
<o:p> </o:p>
2) Point équivalent (d’un point de vue graphique)<o:p></o:p>
Méthode des tangentes<o:p></o:p>
Tangente bas / tangente parallèle haut è parallèle au milieu = point équivalent<o:p></o:p>
<o:p> </o:p>
3) pH à différents points de la courbe<o:p></o:p>
V=0 pH acide fort pH = -log [H3O+] = - log Ca<o:p></o:p>
0 < Vb < Veq pH = - log (Cb. (Veq – Vb)/(Vb + Va)<o:p></o:p>
Vb = Veq pH = 7<o:p></o:p>
Vb > Veq è pH = 14 + log (Cb. (Vb – Veq)/ (Vb+Va))<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
B) Acide faible titré par base forte<o:p></o:p>
Je souhaite connaître la concentration d’un acide faible et je dispose d’une base forte dont on connaît la concentration et le volume.<o:p></o:p>
On fait une équation bilan de cette réaction.<o:p></o:p>
La courbe n’est plus symétrique, elle possède donc deux points d’intérêt : <o:p></o:p>
Le point équivalent (méthode des tangentes)<o:p></o:p>
Le point demi-équivalent qui correspond à pH = pKa<o:p></o:p>
<o:p> </o:p>
X) Solution tampon / pouvoir tampon<o:p></o:p>
Une solution tampon est une solution où le pH varie peu dans deux cas :<o:p></o:p>
Par addition d’un acide ou d’une base forte<o:p></o:p>
Par dilution modérée (eau)<o:p></o:p>
<o:p> </o:p>
Quand on fait un mélange équimolaire d’un acide faible et de sa base conjuguée, on se retrouve à la demi équivalence. C’est la meilleure solution pour créer une solution tampon<o:p></o:p>
<o:p> </o:p>
A) Préparation solution tampon<o:p></o:p>
1/ acide faible + base conjuguée en quantité égale<o:p></o:p>
2/ base faible + acide fort jusqu’à demi équivalence<o:p></o:p>
3/ acide faible + base forte jusqu’à demi équivalence<o:p></o:p>
<o:p> </o:p>
B) Solution tampon en biologie<o:p></o:p>
Le sang humain est tamponné à 7,4, il est régulé par deux couples H2PO4- / HPO42- et CO2 dissous / HCO3-<o:p></o:p>
<o:p> </o:p>
Si pH < 7,4 è acidose<o:p></o:p>
Si pH > 7,4 è alcalose (solution basique = solution alcaline)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Changement d’état <o:p></o:p>
Un corps peut se trouver sous 3 formes :<o:p></o:p>
- solide<o:p></o:p>
- liquide <o:p></o:p>
- gazeux<o:p></o:p>
<o:p> </o:p>
On peut représenter les transitions entre les différents états par un diagramme de phase.
<o:p> </o:p>
Pas de perte ou de création d’énergie<o:p></o:p>
L’énergie de solidification + l’énergie de sublimation = l’énergie de vaporisation <o:p></o:p>
 votre commentaire
votre commentaire Suivre le flux RSS des articles de cette rubrique
Suivre le flux RSS des articles de cette rubrique Suivre le flux RSS des commentaires de cette rubrique
Suivre le flux RSS des commentaires de cette rubrique