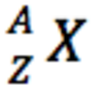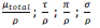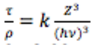-
Métabolisme glucidique<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Généralités<o:p></o:p>
<o:p> </o:p>
II) Chez les glucides<o:p></o:p>
On cherche le maintient de l’homéostasie<o:p></o:p>
Quand <o:p></o:p>
Apport glucidique<o:p></o:p>
Stockage<o:p></o:p>
Glycogénogénèse<o:p></o:p>
<o:p> </o:p>
Carences glucidique<o:p></o:p>
Mobilise réserves<o:p></o:p>
Glycogénolyse / Néoglucogénogénèse<o:p></o:p>
<o:p> </o:p>
III) États prandiaux et transporteurs<o:p></o:p>
Phase absorptive<o:p></o:p>
5 à 8h<o:p></o:p>
Stock en glycogène <o:p></o:p>
Phase post-absorptive<o:p></o:p>
8 à 16h<o:p></o:p>
Dégradation du stock en glycogène (quand pas de néoglucogénèse)<o:p></o:p>
Phase de jeune précoce<o:p></o:p>
16 à 24h<o:p></o:p>
Néoglucogénogénèse hépatique<o:p></o:p>
Phase de jeune prolongé<o:p></o:p>
Plus de 24h<o:p></o:p>
Néoglucogénogénèse hépatique / rénale + cétogénèse <o:p></o:p>
<o:p> </o:p>
Quand on a du glycogène, les monosaccharides sont absorbés par des transporteurs :<o:p></o:p>
- SGLT è transporteurs couplés au sodium avec de l’ATP<o:p></o:p>
- GLUT è passage passif sans ATP<o:p></o:p>
<o:p> </o:p>
Transporteur<o:p></o:p>
Glucides favoris<o:p></o:p>
Localisation <o:p></o:p>
Km<o:p></o:p>
Propriétés<o:p></o:p>
GLUT 1<o:p></o:p>
Glucose<o:p></o:p>
Érythrocytes + cerveau<o:p></o:p>
1 mM<o:p></o:p>
Haute affinité<o:p></o:p>
Faible capacité<o:p></o:p>
GLUT 2<o:p></o:p>
Glucose / fructose / galactose<o:p></o:p>
Cellules β + foie + entérocytes<o:p></o:p>
60 mM<o:p></o:p>
Faible affinité<o:p></o:p>
Haute capacité<o:p></o:p>
GLUT 3<o:p></o:p>
Glucose<o:p></o:p>
Cerveau<o:p></o:p>
1 mM<o:p></o:p>
Haute affinité<o:p></o:p>
Faible capacité<o:p></o:p>
GLUT 4<o:p></o:p>
Glucose<o:p></o:p>
Tissu adipeux + muscles<o:p></o:p>
5 mM<o:p></o:p>
Haute affinité<o:p></o:p>
Faible capacité<o:p></o:p>
GLUT 5<o:p></o:p>
Fructose<o:p></o:p>
Entérocytes<o:p></o:p>
-<o:p></o:p>
-<o:p></o:p>
-<o:p></o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire
-
Protéines<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Organisation<o:p></o:p>
Primaire<o:p></o:p>
- Organisation monomère à polymère<o:p></o:p>
- Enchainement d’acides aminés<o:p></o:p>
Secondaire<o:p></o:p>
- Soumis aux condition environnementales à premier repliement<o:p></o:p>
- Conformation niveau le plus bas à résultat environnement / nature de polymères<o:p></o:p>
Tertiaire<o:p></o:p>
- Organisation tridimensionnel (conformation basse)<o:p></o:p>
- Acquiert sa fonction<o:p></o:p>
- Structure primaire prédispose fonction biologique<o:p></o:p>
Quaternaire<o:p></o:p>
- Interaction protéines-protéines (pas pour toutes les protéines)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
II) Structure de la protéine<o:p></o:p>
Donne des protéines ou de précurseurs de molécules non protéiques (neurotransmetteurs, métabolisme énergétique)<o:p></o:p>
<o:p> </o:p>
Acides aminés sont la base des protéines, et sont codés par le code génétique<o:p></o:p>
Elles sont liées par liaison covalente (peptidiques)<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Structure NH2RHCOOH<o:p></o:p>
Tous les AA ont un carbone asymétrique sauf la glycine (NH2CH2COOH)<o:p></o:p>
Si une molécule possède un carbone asymétrique è stéréo-isomères de configuration (énantiomères)<o:p></o:p>
<o:p> </o:p>
Les énantiomères sont D ou L ???<o:p></o:p>
En Fisher è on place le COOH en haut, le H en bas<o:p></o:p>
Si NH3 à gauche à L<o:p></o:p>
Si NH3 à droite à D<o:p></o:p>
<o:p> </o:p>
En CORN è si on lit CORN de gauche à droite à L<o:p></o:p>
Si on lit CORN de droite à gauche à D<o:p></o:p>
<o:p> </o:p>
Il existe trois grandes classes de protéines à pH physiologique :<o:p></o:p>
<o:p> </o:p>
Polaire et chargé (ionisable) à chaine R hydrophile<o:p></o:p>
Aspartate<o:p></o:p>
Asp<o:p></o:p>
D<o:p></o:p>
Charge négative<o:p></o:p>
Acide carboxylique<o:p></o:p>
Glutamate<o:p></o:p>
Glu<o:p></o:p>
E<o:p></o:p>
Charge négative<o:p></o:p>
Acide carboxylique<o:p></o:p>
Histidine<o:p></o:p>
His<o:p></o:p>
H*<o:p></o:p>
Charge positive<o:p></o:p>
Amine<o:p></o:p>
Lysine<o:p></o:p>
Lys<o:p></o:p>
K*<o:p></o:p>
Charge positive<o:p></o:p>
Amine<o:p></o:p>
Arginine<o:p></o:p>
Arg<o:p></o:p>
R<o:p></o:p>
Charge positive<o:p></o:p>
Amine<o:p></o:p>
Polaire et non chargé<o:p></o:p>
Tyrosine<o:p></o:p>
Tyr<o:p></o:p>
Y<o:p></o:p>
/<o:p></o:p>
Alcool (phosphorylé)<o:p></o:p>
Thréonine<o:p></o:p>
Thr<o:p></o:p>
T*<o:p></o:p>
/<o:p></o:p>
Alcool<o:p></o:p>
Sérine<o:p></o:p>
Ser<o:p></o:p>
S<o:p></o:p>
/<o:p></o:p>
Alcool<o:p></o:p>
Asparagine<o:p></o:p>
Asn<o:p></o:p>
N<o:p></o:p>
/<o:p></o:p>
Amide<o:p></o:p>
Glutamine<o:p></o:p>
Gln<o:p></o:p>
Q<o:p></o:p>
/<o:p></o:p>
Amide<o:p></o:p>
Cystéine<o:p></o:p>
Cys<o:p></o:p>
C<o:p></o:p>
/<o:p></o:p>
Thiol (pont disulfure à fige structure tridimensionnel)<o:p></o:p>
Non polaire et non chargé (chaine R hydrophobe)<o:p></o:p>
Glycine<o:p></o:p>
Gly<o:p></o:p>
G<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Alanine<o:p></o:p>
Ala<o:p></o:p>
A<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Valine<o:p></o:p>
Val<o:p></o:p>
V*<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Leucine<o:p></o:p>
Leu<o:p></o:p>
L*<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Isoleucine<o:p></o:p>
Ile<o:p></o:p>
I*<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Méthionine<o:p></o:p>
Met<o:p></o:p>
M*<o:p></o:p>
/<o:p></o:p>
Chaine aliphatique<o:p></o:p>
Phénylalanine<o:p></o:p>
Phe<o:p></o:p>
F*<o:p></o:p>
/<o:p></o:p>
Aromatique<o:p></o:p>
Tryptophane<o:p></o:p>
Trp<o:p></o:p>
W*<o:p></o:p>
/<o:p></o:p>
Aromatique<o:p></o:p>
Proline<o:p></o:p>
Pro<o:p></o:p>
P<o:p></o:p>
/<o:p></o:p>
Hétéroxyde à formation coude béta<o:p></o:p>
Si il y a des interactions entre charge positive et négative quand il y a repliement è pont salin<o:p></o:p>
* AA essentiels provient de l’alimentation<o:p></o:p>
<o:p> </o:p>
III) Propriétés<o:p></o:p>
<o:p> </o:p>
IV) Propriétés chimiques<o:p></o:p>
Il existe beaucoup d’AA mais seul 20 AA sont reconnus<o:p></o:p>
Il existe plusieurs types de réactions :<o:p></o:p>
- désamination oxydative : NH3 éliminé è Cα devient une cétone<o:p></o:p>
- décarboxylation : élimination CO2<o:p></o:p>
- transamination : métabolisme des protéines en AA essentiels et en AA non essentiels<o:p></o:p>
- amidation permet la liaison peptidique : condensation de deux AA<o:p></o:p>
<o:p> </o:p>
A) Modification dans la protéine (post-traductionnelle)<o:p></o:p>
AA devient un intermédiaire métabolique<o:p></o:p>
hydroxylation<o:p></o:p>
Ajout d’un OH<o:p></o:p>
Proline / Lysine<o:p></o:p>
Définitive<o:p></o:p>
γ-carboxylation<o:p></o:p>
Ajout d’un COOH<o:p></o:p>
Glutamate<o:p></o:p>
<o:p> </o:p>
Phosphorylation<o:p></o:p>
Ajour d’un groupement phosphate<o:p></o:p>
Sérine / Tyrosine / Thréonine<o:p></o:p>
Réversible<o:p></o:p>
Acétylation<o:p></o:p>
Ajout d’un CO<o:p></o:p>
Lysine<o:p></o:p>
Réversible<o:p></o:p>
<o:p> </o:p>
B) Modification AA libre<o:p></o:p>
- Par substitution : Arginine è citruline è orthinine<o:p></o:p>
- Par décarboxylation : Histidine è histamine<o:p></o:p>
- Tyrosine peut donner la T3 et la T4 (hormones thyroïdienne) <o:p></o:p>
<o:p> </o:p>
V) Formation du polymère<o:p></o:p>
On lit de la terminaison N-terminale à C-terminale<o:p></o:p>
Donc V-A ≠ A-V<o:p></o:p>
Quand il y a une erreur, la protéine est mal orienté et cela entraine des maladies génétiques.<o:p></o:p>
La configuration trans (haut/bas/haut) à stabilité maximale<o:p></o:p>
Proline créer une configuration cis qui crée une liaison à 90° qui forme un coude béta<o:p></o:p>
<o:p> </o:p>
VI) Organisation spatiale<o:p></o:p>
A) Structure primaire<o:p></o:p>
- Toutes les chaines polaires sont dans le même plan et les chaines apolaires sont un plan opposé<o:p></o:p>
- Permet une prédisposition de l’organisation tridimensionnel en créant la fonction biologique et une stabilisation des liaisons hydrophobes è si il y a une altération alors la protéine ne sera pas fonctionnelle<o:p></o:p>
Si > 100 AA è protéine<o:p></o:p>
Si < 100 AA è peptide<o:p></o:p>
<o:p> </o:p>
Les enzymes permettent la catalyse des protéines et se nomment les peptidases<o:p></o:p>
Il existe deux types de peptidases :<o:p></o:p>
- Exopeptidase : coupe extrémités des amines et des acides carboxyliques<o:p></o:p>
- Endopeptidase : coupe intérieur quand trypsine (à droite de K et R)/ chymotrypsine (à droite de W, F, Y)<o:p></o:p>
<o:p> </o:p>
B) Structure secondaire<o:p></o:p>
- Pelotte statistique à structure organisée par mécanismes de répulsion de l’eau et groupement apolaire (se fait dans le cytosol)<o:p></o:p>
- linéaire de constitution è non linéaire, formé et stabilisé par liaison H<o:p></o:p>
<o:p> </o:p>
2 motifs :<o:p></o:p>
a) L’hélice α (protéine globulaire) souple<o:p></o:p>
Type ressort è pas hélice constant è 4 AA qui tourne vers la droite<o:p></o:p>
Chaine latérale projeté à l’extérieur è minimise encombrement stérique<o:p></o:p>
Stabilisé par un pont H<o:p></o:p>
Glu, Asp, His, Lys, Arg peu représenté<o:p></o:p>
Pro n’est jamais exprimé<o:p></o:p>
<o:p> </o:p>
b) Le feuillet β étiré<o:p></o:p>
Séquence plissée è implique une proline è coude β<o:p></o:p>
Stabilisation par pont H entre NH3 et COOH<o:p></o:p>
Si la chaine est courte à la liaison pas éloignée<o:p></o:p>
Si la chaine est longue à la liaison très éloignée<o:p></o:p>
Feuillet antiparallèle éêé ou parallèle êêê<o:p></o:p>
Pro et Lys peu exprimés<o:p></o:p>
Val et Ile exprimés<o:p></o:p>
Coude β<o:p></o:p>
Quand on arrive à la surface de la cellule, on a un coude β<o:p></o:p>
Succession de 4 AA permet le changement de direction (proline en 2, configuration en cis)<o:p></o:p>
Jamais de AA apolaires<o:p></o:p>
<o:p> </o:p>
C) Structure tertiaire (détermine l’expression de la fonction biologique)<o:p></o:p>
Interactions non covalentes pour avoir une structure tridimensionnel et fonctionnelle :<o:p></o:p>
- Hydrophobes : conséquence répulsion ècréer cœur / noyau central de la protéine<o:p></o:p>
- Hydrophiles : ponts salins (ionisation chaine latérale des AA polaires)<o:p></o:p>
- Hydrogènes : entre carbonyle et NH3<o:p></o:p>
Mais aussi des ponts disulfures<o:p></o:p>
<o:p> </o:p>
Il existe deux types de protéines :<o:p></o:p>
- les fibreuses : α ; soluble ; impliqué dans métabolisme ; hydrophile<o:p></o:p>
- les globulaires : β ; rigide ; hydrophobes ; organisation supramoléculaire<o:p></o:p>
<o:p> </o:p>
Les pathologies des protéines provenant de la structure tridimensionnelle :<o:p></o:p>
- Vache folle : mauvais repliement<o:p></o:p>
- Parkinson : Protéine particulière<o:p></o:p>
- Alzheimer : peptide α/β générant les plaques d’amyloïdes <o:p></o:p>
<o:p> </o:p>
D) Structure quaternaire (base de la régulation de la voie métabolique)<o:p></o:p>
Assemblage de plusieurs polypeptides è oligomérisation<o:p></o:p>
- homo-oligomérisation è plusieurs protéines identiques<o:p></o:p>
- hétéro-oligomérisation è plusieurs protéines différentes<o:p></o:p>
Stabilisé par des liaisons non covalentes dans le cœur hydrophobes<o:p></o:p>
<o:p> </o:p>
Dénaturation protéique : casse toutes les liaisons hydrogènes sauf celles de la structure primaire è pelotte statistique (cause : chaleur/ pH/ métaux lourds)<o:p></o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire
-
Particules, ondes et atomes<o:p></o:p>
<o:p> </o:p>
I) Introduction<o:p></o:p>
· 3 types de radiations ionisantes<o:p></o:p>
- Les rayons X proviennent du cortège électronique et sont utilisé en radiologie<o:p></o:p>
- Les ondes électromagnétiques sont utilisées en IRM<o:p></o:p>
- La radioactivité provient du noyau et est utilisée en médecine nucléaire<o:p></o:p>
<o:p> </o:p>
· 3 découvertes importantes<o:p></o:p>
- William Roentgen è Rayon X<o:p></o:p>
- Henri Becquerel, Pierre et Marie Curie è Rayons α, β et γ<o:p></o:p>
- Cédric et Irène Curie è Radioactivité artificielle<o:p></o:p>
<o:p> </o:p>
II) Masse et énergie<o:p></o:p>
Il existe deux systèmes de mesure :<o:p></o:p>
Le SI (système international) et le MKSA (mole, kilo, seconde, ampère)<o:p></o:p>
<o:p> </o:p>
La masse relativiste est constante <o:p></o:p>
Quand v < c alors m = m0
<o:p></o:p>
<o:p> </o:p>
La notation des atomes est <o:p></o:p>
A : nombre de nucléons (neutrons + protons)<o:p></o:p>
Z : nombre de protons (électrons quand l’atome est neutre)<o:p></o:p>
<o:p> </o:p>
· Le gramme (la masse [molaire] atomique)<o:p></o:p>
C’est la masse de N atome sachant que 1 mole de 12C = 12g<o:p></o:p>
Le nombre d’Avogadro est égal à 6,02.1023<o:p></o:p>
<o:p> </o:p>
· L’unité de masse atomique (u)<o:p></o:p>
Elle est adaptée à l’échelle des atomes<o:p></o:p>
La masse en u est égale à la masse en g<o:p></o:p>
<o:p> </o:p>
· Énergie de masse<o:p></o:p>
E = mc2<o:p></o:p>
E0 = m0c2 au repos<o:p></o:p>
Et = E0 + Ec è Ec = Δmc2 E0 est une particule en mouvement<o:p></o:p>
<o:p> </o:p>
III) Particules matérielles<o:p></o:p>
Nom<o:p></o:p>
Électron <o:p></o:p>
Proton <o:p></o:p>
Neutron<o:p></o:p>
Positron <o:p></o:p>
Neutrino <o:p></o:p>
Particule α<o:p></o:p>
Sigle<o:p></o:p>
e-<o:p></o:p>
p+<o:p></o:p>
n0<o:p></o:p>
β+<o:p></o:p>
ν<o:p></o:p>
α<o:p></o:p>
Masse au repos<o:p></o:p>
me = 9,109.10-28 g<o:p></o:p>
mp = 1,007u<o:p></o:p>
mn = 1,009u<o:p></o:p>
m = 1/2000u<o:p></o:p>
Quasi nulle<o:p></o:p>
m = 4,0015u <o:p></o:p>
(2mp + 2mn)<o:p></o:p>
Vitesse relativiste<o:p></o:p>
pour V = 0,5c <o:p></o:p>
me = 1,15 m0<o:p></o:p>
<o:p> </o:p>
Non relativiste<o:p></o:p>
Non relativiste<o:p></o:p>
/<o:p></o:p>
/<o:p></o:p>
/<o:p></o:p>
Charge<o:p></o:p>
-e = 1,602.10-19 C<o:p></o:p>
1eV = 1,602.10-19 J<o:p></o:p>
+e = 1,602.10-19 C<o:p></o:p>
<o:p> </o:p>
Nulle<o:p></o:p>
+e = 1,602.10-19 C<o:p></o:p>
<o:p> </o:p>
Nulle <o:p></o:p>
2e = 3,204.10-19 C<o:p></o:p>
<o:p> </o:p>
Stabilite<o:p></o:p>
/<o:p></o:p>
Stable<o:p></o:p>
Stable à l’intérieur du noyau mais pas à l’extérieur<o:p></o:p>
/<o:p></o:p>
/<o:p></o:p>
/<o:p></o:p>
…<o:p></o:p>
Électron quand il est autour du noyau <o:p></o:p>
Négaton quand il sort du noyau<o:p></o:p>
/<o:p></o:p>
/<o:p></o:p>
Antiparticule de l’électron (opposé au négaton β-)<o:p></o:p>
Explique la radioactivité β<o:p></o:p>
4 nucléons : noyau He / He++ / α / α++<o:p></o:p>
<o:p> </o:p>
IV) Rayonnements électromagnétiques (ou photons)<o:p></o:p>
· Représentation ondulatoire classique<o:p></o:p>
Mode de transport d’énergie<o:p></o:p>
Perturbation par propagation du champ électrique et magnétique en phase<o:p></o:p>
Perpendiculaire par rapport à la direction de propagation<o:p></o:p>
ν = c/λ<o:p></o:p>
<o:p> </o:p>
· Spectre des rayonnements magnétiques<o:p></o:p>
Fréquence inversement proportionnelle à la longueur d’onde<o:p></o:p>
On différencie les rayons X (cortège) des rayons γ en fonction de leur origine et pas de leur énergie<o:p></o:p>
<o:p> </o:p>
· Représentation quantique
<o:p></o:p>
V) Dualité onde-particules<o:p></o:p>
Einstein découvre l’aspect corpusculaire (photon)<o:p></o:p>
De Broglie découvre l’aspect ondulatoire<o:p></o:p>
<o:p> </o:p>
VI) Structure électronique de l’atome<o:p></o:p>
· Modèle planétaire de Rutherford<o:p></o:p>
La diffusion d’une particule à travers une feuille métallique est incompatible avec le modèle sphérique<o:p></o:p>
<o:p> </o:p>
· Modèle de Bohr<o:p></o:p>
Le nombre d’électrons suivant le nombre de couche remplies est de 2n2 au maximum<o:p></o:p>
<o:p> </o:p>
Wk varie beaucoup d’un atome à l’autre mais Wext varie peu<o:p></o:p>
 votre commentaire
votre commentaire
-
Interaction des rayonnements ionisants avec la matière<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
Interaction : transfert d’énergie d’un point A à B de la matière<o:p></o:p>
Conséquences positives : on peut détecter les particules (radiotraitement …)<o:p></o:p>
négatives : on peut créer des dangers (bombe atomique, centrales nucléaires …)<o:p></o:p>
Quand une particule a une masse on parle de rayonnement particulaire.<o:p></o:p>
Quand un particule n’a pas de masse on parle de rayonnement particulaire.<o:p></o:p>
<o:p> </o:p>
I) Interactions élémentaires<o:p></o:p>
C’est une collision entre une particule (électron) et un milieu : permet le transfert d’énergie<o:p></o:p>
<o:p> </o:p>
· Absorption par excitation<o:p></o:p>
Quand l’énergie d’un photon E < énergie de liaison |Wi|<o:p></o:p>
E = |Wi| - |Wj|<o:p></o:p>
L’atome excité passe sur une couche supérieure.<o:p></o:p>
L’énergie absorbée est alors quantifiée<o:p></o:p>
<o:p> </o:p>
· Absorption par ionisation<o:p></o:p>
E > |Wi| on a une ionisation è l’électron est expulsé avec une énergie T<o:p></o:p>
T = hν - |Wi|<o:p></o:p>
L’’énergie absorbée n’est pas quantifiée<o:p></o:p>
<o:p> </o:p>
· Émission d’un photon de fluorescence<o:p></o:p>
Quand excitation <o:p></o:p>
Quand ionisation<o:p></o:p>
à Case vacante + énergie absorbée<o:p></o:p>
à Case vacante + énergie absorbée<o:p></o:p>
à Restitution architecture structurale<o:p></o:p>
à Restitution architecture structurale<o:p></o:p>
à L’électron redescend d’une couche <o:p></o:p>
à L’électron redescend d’une couche et un électron libre bouche la case vacante<o:p></o:p>
à Émission d’un photon de fluorescence<o:p></o:p>
à Émission d’un photon de fluorescence<o:p></o:p>
E = |Wi|<o:p></o:p>
E1 + E2 + E3 + … = |Wi|<o:p></o:p>
<o:p> </o:p>
· Émission d’un électron Auger<o:p></o:p>
Un photon de fluorescence entraine un électron libre sur une couche i è peut expulser un électron périphérique sur une couche x qui sera l’électron Auger d’énergie T<o:p></o:p>
T = |Wi| - |Wx|<o:p></o:p>
<o:p> </o:p>
· Définition des rayonnements ionisant<o:p></o:p>
Un rayonnement ionisant est capable d’arracher un électron à un atome.<o:p></o:p>
L’énergie pour un atome d’hydrogène est 13,6 eV<o:p></o:p>
Quand l’énergie > 13,6 eV on dit que le rayonnement est ionisant <o:p></o:p>
<o:p> </o:p>
II) Interactions des photons<o:p></o:p>
· Loi d’atténuation des photons dans la matière<o:p></o:p>
Loi intégrée : nombre de photons après la traversée en fonction du nombre de photons à l’entrée du matériaux d’épaisseur x<o:p></o:p>
N(x) = N(0)e-μx avec μ le coefficient linéique d’atténuation en cm-1 (dépend de l’énergie du photon/milieu <o:p></o:p>
Coefficient massique d’atténuation = μ/ρ<o:p></o:p>
Le coefficient massique d’atténuation n’atteindra jamais 0 car il n’est pas arrêté mais juste atténué par les rayonnements électromagnétiques.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
· Mécanismes d’atténuation<o:p></o:p>
Ø Effet photoélectrique :<o:p></o:p>
Les électrons absorbent la totalité de l’énergie des photons qui sont expulsés avec une charge.<o:p></o:p>
Ces derniers percutent un autre électron et change alors de trajectoire, perdent de l’énergie jusqu’à leur arrêt complet <o:p></o:p>
Les photons γ et X ont un caractère aléatoire<o:p></o:p>
La probabilité d’interaction par effet photoélectrique :
<o:p></o:p>
La probabilité est maximale pour un Z important et un hν faible.<o:p></o:p>
L’effet photoélectrique améliore l’image radiographique<o:p></o:p>
<o:p> </o:p>
Ø Effet Compton<o:p></o:p>
Il y a deux types d’énergies émises :<o:p></o:p>
- Photoélectron émis è E = hν2<o:p></o:p>
- Photoélectron expulsé è T<o:p></o:p>
hν1 = T + hν2<o:p></o:p>
/ !\ Il peut y avoir un électron de fluorescence ou un électron Auger<o:p></o:p>
Quand θ = 0 è absence de photoélectron<o:p></o:p>
Quand θ = π è choc frontal donc l’électron rebondit<o:p></o:p>
<o:p> </o:p>
N(x) = N(0) e-σx<o:p></o:p>
<o:p> </o:p>
Ø Diffusion Thomson-Rayleigh<o:p></o:p>
C’est un changement de direction sans changement de λ<o:p></o:p>
<o:p> </o:p>
Ø Phénomène de création de paires (de matérialisation)<o:p></o:p>
C’est un phénomène qui ne peut se faire qu’à partir de 1022 KeV<o:p></o:p>
L’onde / photon passe à côté du noyau, il y a résonance et on observe des émissions e- / β+<o:p></o:p>
L’e- va dans la matière à collision à arrêt<o:p></o:p>
Le photon β+ va dans la matière à collision avec e- à phénomène d’annihilation à les deux photons parte à 180° chacun<o:p></o:p>
<o:p> </o:p>
Ø Importance relative des interactions<o:p></o:p>
- Selon l’énergie è sur le même graphique on met <o:p></o:p>
- Selon le milieu è si on est dans un milieu composé de métaux lourds, on observe un pic d’énergie de liaison pour |Wi| et |W2|<o:p></o:p>
<o:p> </o:p>
III) Interactions particulaires<o:p></o:p>
· Interaction des neutrons avec la matière<o:p></o:p>
Ø Neutrons rapides (par capture radioactive)<o:p></o:p>
Ils ont un caractère stochastique è si ils atterrissent sur un noyau d’hydrogène è atténuation<o:p></o:p>
Si ils atterrissent sur un autre noyau è rebondissent<o:p></o:p>
<o:p> </o:p>
Ø Neutrons thermiques (par activation neutronique)<o:p></o:p>
Peuvent être absorbés par le noyau è création d’isotopes<o:p></o:p>
<o:p></o:p>
· Interaction des particules chargées avec la matière (α / β-)<o:p></o:p>
Quand la particule est chargée, la matière est chargée donc il a obligatoirement une interaction avec la matière. <o:p></o:p>
L’énergie est déposée dans la matière.<o:p></o:p>
α et β- sont des particules lourdes qui ont une trajectoire rectiligne avec un électron arraché, il y a perte d’énergie donc un maximum d’ionisation et un arrêt.<o:p></o:p>
On obtient alors un courbe de Bragg qui au delà d’une certaine épaisseur, plus aucune énergie n’est déposée.<o:p></o:p>
On observe sur la courbe de Bragg, un pic qui correspond au maximum d’énergie déposé dans les tissus.<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
Papier<o:p></o:p>
Main<o:p></o:p>
Bois<o:p></o:p>
Plomb<o:p></o:p>
α<o:p></o:p>
à stop<o:p></o:p>
<o:p> </o:p>
β<o:p></o:p>
<o:p> </o:p>
à stop<o:p></o:p>
<o:p> </o:p>
γ<o:p></o:p>
<o:p> </o:p>
Atténué mais arrête pas <o:p></o:p>
X<o:p></o:p>
<o:p> </o:p>
Atténué mais arrête pas<o:p></o:p>
<o:p> </o:p>
Neutron <o:p></o:p>
<o:p> </o:p>
Atténué mais arrête pas<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire