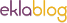-
Chapitre 1 : Ondes et particules<o:p></o:p>
I) Sources de rayonnements<o:p></o:p>
1) Dualité onde-particule<o:p></o:p>
Le rayonnement est la propagation d’énergie émise par une source, il en existe deux types :<o:p></o:p>
- Le rayonnement de particules est un déplacement d’énergie avec un déplacement de matière<o:p></o:p>
- Le rayonnement électromagnétique est un déplacement d’énergie SANS déplacement de matière<o:p></o:p>
<o:p> </o:p>
Toutes les ondes électromagnétiques sont caractérisés par leur fréquence ν ; mais aussi par sa longueur d’onde λ dans le vide où la vitesse de la lumière c = 3,00 . 108 m.s-1<o:p></o:p>
<o:p> </o:p>
La fréquence ne change jamais<o:p></o:p>
<o:p> </o:p>
2) Types et sources de rayonnement<o:p></o:p>
a) Sources de rayonnements de particules<o:p></o:p>
L’univers est parcouru par des noyaux ou particules élémentaires et se déplace à grande vitesse c’est un rayonnement cosmique.<o:p></o:p>
<o:p> </o:p>
Les supernovas en serai l’origine selon les physiciens<o:p></o:p>
<o:p> </o:p>
b) Sources de rayonnement électromagnétique<o:p></o:p>
Suivant la quantité d’énergie qui se propage, les longueurs d’ondes différent.<o:p></o:p>
Les rayonnements électromagnétiques sont divisés en différentes catégories <o:p></o:p>
<o:p> </o:p>
Les plus énergétiques sont les rayons gamma, les rayons X et les ultraviolets<o:p></o:p>
Les moins énergétiques sont les ondes radio, les micro-ondes et les infrarouges<o:p></o:p>
<o:p> </o:p>
Dans l’univers on retrouve tous les rayonnements du spectre<o:p></o:p>
On sait créer ces rayons à des fins spécifiques<o:p></o:p>
<o:p> </o:p>
3) Les ondes mécaniques<o:p></o:p>
Elles ne se propagent que dans la matière comme dans la houle, es séismes ou encore les ondes sonores …<o:p></o:p>
C’est une propagation d’énergie mais pas de matière.<o:p></o:p>
<o:p> </o:p>
II) Détection d’ondes et de particules<o:p></o:p>
1) Les ondes<o:p></o:p>
a) Les ondes mécaniques<o:p></o:p>
Les ondes sonores sont captées à l’aide de microphones<o:p></o:p>
Les ondes sismiques sont captées à l’aide de sismographes qui mesure la magnitude des séismes sur l’échelle de Richter<o:p></o:p>
<o:p> </o:p>
b) Les ondes électromagnétiques<o:p></o:p>
Le premier détecteur naturel est l’œil, il transforme les rayonnements visibles en signaux électriques puis il y a d’autres détecteurs électromagnétiques artificiels qui exercent la propriété de libérer des électrons à la rencontre des rayonnements électromagnétiques è c’est l’effet photoélectrique<o:p></o:p>
Les électrons libérés forme un courant électrique<o:p></o:p>
<o:p> </o:p>
2) Les particules<o:p></o:p>
On peut citer le compteur Geiger qui détecte la radioactivité<o:p></o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire
-
Chapitre 8 :<o:p></o:p>
Temps et relativité restreinte<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Invariance de la vitesse de la lumière<o:p></o:p>
- Loi de composition des vitesses de Galilée<o:p></o:p>
- Le début du XX° siècle, ne concerne pas vit de la lumière qui garde la même vitesse.<o:p></o:p>
- A la fin du XIX° siècle Michelson le met en évidence que la vitesse ne dépend pas du mouvement de la Terre.<o:p></o:p>
- En 1905 Einstein met en place la théorie de la relativité qui est fondée sur l’invariance de la célérité de la lumière<o:p></o:p>
<o:p> </o:p>
II) Référentiels et horloges<o:p></o:p>
- La théorie de la relativité d’Einstein est aussi fondée sur le principe de la relativité dans de principe physique identiques dans R et R’ deux référentiels galiléens.<o:p></o:p>
<o:p> </o:p>
Des événements, phénomènes qui se produisent en un endroit précis et un endroit donné dans le temps.<o:p></o:p>
Exemple : le référentiel galiléen dans lequel E1 et E2 ont lieu du même endroit de l’espace qui est appelé référentiel propre pour E1 et E2<o:p></o:p>
Un référentiel propre est l’horloge qui lui est associé et qui mesure un intervalle de temps entre ces événements appelés la durée propre entre E1 et E2<o:p></o:p>
<o:p> </o:p>
- Le temps propre est celui indiqué par l’horloge associé au référentiel propre<o:p></o:p>
- La durée est un intervalle de temps mesuré par l’horloge d’un référentiel entre deux événements<o:p></o:p>
- L’horloge associée au référentiel indique une date<o:p></o:p>
- L’horloge est précise / stable / universelle<o:p></o:p>
<o:p> </o:p>
III) Relativité du temps<o:p></o:p>
1) Caractères relatifs des durées<o:p></o:p>
- Dans la théorie de la relativité un événement est défini par un point de l’espace et un instant unique<o:p></o:p>
- Le temps n’est pas absolu : deux événements simultanées dans un référentiel ne le sont pas dans un autre référentiel en mouvement par rapport au premier.<o:p></o:p>
- Tout référentiel doit associer à une horloge qui lui est propre.<o:p></o:p>
<o:p> </o:p>
2) Dilatation des durées<o:p></o:p>
L’intervalle de temps entre deux événements mesurés dans le référentiel propre galiléen R est toujours plus court que l’intervalle de temps Δt’ entre ces deux événements mesurés dans un autre référentiel galiléen R’ se déplaçant à la vitesse v par rapport à R<o:p></o:p>
<o:p> </o:p>
<o:p></o:p>
 votre commentaire
votre commentaire
-
Chapitre 9<o:p></o:p>
Temps et évolution chimique : cinétique et catalyse<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Durée de réaction<o:p></o:p>
1) Réaction lente et rapide<o:p></o:p>
Au cours d’une réaction chimique le système évolue :<o:p></o:p>
- initial : réactif mis en contact<o:p></o:p>
- final : composition du système ne change plus<o:p></o:p>
<o:p> </o:p>
La durée est très variable entre deux états<o:p></o:p>
La réaction lente ou rapide est choisi arbitrairement par l’expérimentateur (une réaction rapide met moins d’une seconde pour se faire)<o:p></o:p>
La cinétique chimique est l’étude du caractère plus ou moins rapide des transformations chimiques.<o:p></o:p>
<o:p> </o:p>
2) Évolution de la quantité de matière au cours du temps<o:p></o:p>
Plus l’avancement augmente plus les produits augmentent et les réactifs diminuent.<o:p></o:p>
Pour connaître la quantité de matière :<o:p></o:p>
- on peut utiliser un spectrophotomètre (pour les solutions colorées)<o:p></o:p>
- on peut utiliser des dosages<o:p></o:p>
- on peut utiliser un pH-mètre<o:p></o:p>
<o:p> </o:p>
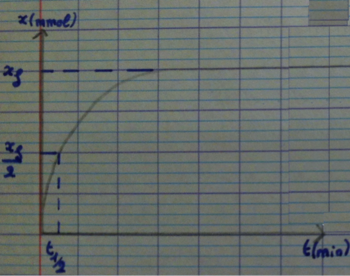
3) Temps de demie réaction<o:p></o:p>
Le temps de demie réaction notée t½ est la durée au bout de laquelle l’avancement de la réaction vaut la moitié de sa valeur finale xf<o:p></o:p>
x(½) = xf / 2 <o:p></o:p>
Les systèmes chimiques cessent d’évoluer à quelques dizaines de t½ (le temps de demie-réaction est différente de la moitié du temps de la réaction.<o:p></o:p>
<o:p> </o:p>
Détermination d’un temps de demie réaction<o:p></o:p>
Il s’obtient graphiquement à partir d’une courbe de l’avancement au cours du temps.<o:p></o:p>
Un oxydant est réduit donc il gagne des électrons<o:p></o:p>
Un réducteur perd des électrons.<o:p></o:p>
H2O2 / H2O<o:p></o:p>
I2 / I-<o:p></o:p>
<o:p> </o:p>
2I- = I2 + 2e-<o:p></o:p>
2H+ + H2O2 + 2e- = 2H2O<o:p></o:p>
2H+ + H2O2 + 2I-
 I2 + 2H2O<o:p></o:p>
I2 + 2H2O<o:p></o:p><o:p> </o:p>
Par spectroscopie on peut suivre la concentration de I2 en fonction du temps et suivre l’avancement<o:p></o:p>
On peut faire pareil avec un réactif<o:p></o:p>
Choix de la technique de suivie et temps de suivie et temps de demie réaction<o:p></o:p>
Il faut que le temps de réponse de la technique ou de l’appareil doit être très inférieur au temps de demi réaction de la transformation<o:p></o:p>
Exemple : les appareils de mesure tels que le pH-mètre et le spectrophotomètre ne fournissent pas de résultats instantanées. Le temps de réponse d’une électrode de pH-mètrie met 20 secondes.<o:p></o:p>
<o:p> </o:p>
II) Facteurs cinétiques<o:p></o:p>
Un facteur cinétique est un paramètre expérimental qui a une influence sur la durée d’une réaction : la température, la concentration, le solvant sont des facteurs cinétiques.<o:p></o:p>
Les industriels doivent limiter les couts et le temps de la transformations ce qui permet d’augmenter la rentabilité.<o:p></o:p>
<o:p> </o:p>
1) Influence de la concentration<o:p></o:p>
En général plus la concentration initiale des réactifs est élevé plus la durée de réaction est faible<o:p></o:p>
<o:p> </o:p>
2) Influence de la température<o:p></o:p>
En général une augmentation du milieu réactionnel entraine une diminution de la durée de réaction<o:p></o:p>
<o:p> </o:p>
Ex : de nombreux montages de synthèses comme le chauffage à reflux qui maintient le mélange réactionnel à température d’ébullition du solvant et évite la perte de matière. Les espèces chimiques volatiles se condensent dans le réfrigérant et tombe dans le ballon.<o:p></o:p>
<o:p> </o:p>
L’effet inverse est exploité pour la conservation des aliments qui sont maintenu à 4°C au réfrigérateur et -18°C au congélateur.<o:p></o:p>
Toutes les réactions chimiques qui sont responsables de l’altération sont ralenties ce qui permet la conservation.<o:p></o:p>
<o:p> </o:p>
3) Influence du solvant<o:p></o:p>
Il a un rôle essentiel : celui de solubiliser les réactifs pour favoriser leur contact et parfois il est susceptible d’interagir avec les espèces chimiques et d’altérer le transformateur.<o:p></o:p>
Le choix du solvant influe sur la durée de réaction.<o:p></o:p>
<o:p> </o:p>
III) Catalyse<o:p></o:p>
Définition : un catalyseur est une espèce chimique qui diminue la durée de réaction dans le milieu réactionnel où il est introduit. Il n’apparaît pas dans l’équation de la réaction.<o:p></o:p>
La quantité de catalyseur est identique à l’état initial et final, il est consommé puis régénéré.<o:p></o:p>
Un catalyseur fragilise certaines liaisons chimiques pour faciliter au réactif la transformation.<o:p></o:p>
Un catalyseur agit uniquement sur la vitesse, il permet d’atteindre plus vite l’état final sans en modifier sa composition.<o:p></o:p>
Convenablement choisi, il peut aussi éviter des réaction parasites, on parle alors de catalyse sélective.<o:p></o:p>
Deux espèces sont dans la même phase si leur mélange est homogène.<o:p></o:p>
<o:p> </o:p>
1) Catalyse hétérogène<o:p></o:p>
Quand les réactifs et le catalyseur se situe dans des phases différentes la catalyse est dite hétérogène le plus souvent le catalyseur est solide.<o:p></o:p>
Les réactifs sont liquides ou gaz. Quand le catalyseur est sous une forme différente des réactifs, on peut les séparer facilement.<o:p></o:p>
Ce sont des métaux qui augmentent fortement le cout de la synthèse comme fer qui est le catalyseur de l’ammoniac et du pot catalytique.<o:p></o:p>
<o:p> </o:p>
2) Catalyse homogène<o:p></o:p>
Quand les réactifs et le catalyseur se situe tous dans la même phase, la catalyse est dite homogène le plus souvent le catalyseur est liquide.<o:p></o:p>
Elle est d’autant plus efficace qu’elle est concentrée. Ils sont moins couteux mais difficile à extraire comme l’acide sulfurique<o:p></o:p>
<o:p> </o:p>
3) Catalyse enzymatique<o:p></o:p>
Les enzymes sont des catalyseurs biologiques : elle joue un rôle primordial chez les êtres vivants en accélérant les réactions chimiques du métabolisme. Le plus souvent ce sont des protéines. Elle est très efficace et sélective. Il agissant sous des conditions « douces » : milieu aqueux, température basse, pH de 7 è intérêt croissant.<o:p></o:p>
Elle évite les dépenses d’énergie et le recours à des solvants nocifs.<o:p></o:p>
Ex : la plupart des lessives contiennent des protéases qui catalysent les produits qui sont responsables de la dégradation des protéines d’origine organique (tache de sang, herbe). Les lessives à froid utilise des enzymes extraites de bactéries etc…<o:p></o:p>
 votre commentaire
votre commentaire
-
Chapitre 19 – Stratégies de synthèse et sélectivité en chimie organique<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Sécurité et cout<o:p></o:p>
1) Sécurité <o:p></o:p>
Tenue vestimentaire (blouse …)<o:p></o:p>
Sécurité du montage (verrerie bien fixée …)<o:p></o:p>
Risque lié au réactif <o:p></o:p>
Les déplacements<o:p></o:p>
Traitement des déchets<o:p></o:p>
<o:p> </o:p>
2) Cout <o:p></o:p>
Prix des réactifs<o:p></o:p>
Prix des solvants<o:p></o:p>
Prix des catalyseurs<o:p></o:p>
Cout énergétique<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
II) Analyse des protocoles<o:p></o:p>
1) Espèces chimiques mise en jeu<o:p></o:p>
Quels produit / catalyseur / espèces chimiques / quantités sont introduites ?<o:p></o:p>
<o:p> </o:p>
2) Choix des paramètres expérimentaux<o:p></o:p>
La température (facteur cinétique : état physique des composés).<o:p></o:p>
Le solvant (facteur cinétique : solubilisation des réactifs).<o:p></o:p>
Le pH (facteur cinétique : solubilisation des réactifs avec réaction parasites).<o:p></o:p>
La durée de la réaction.<o:p></o:p>
<o:p> </o:p>
3) Choix du montage<o:p></o:p>
Agitateur magnétique servant à homogénéiser / solubiliser les réactif et la température.<o:p></o:p>
Ampoule de coulée permettant d’ajouter un réactif progressivement.<o:p></o:p>
Montage à reflux permet une augmentation de la température du milieu sans risques et sans pertes par évaporation la réaction peut se faire à température maximale ou à température d’ébullition. Les vapeurs se condensent dans le réfrigérant. On ajoute des pierres ponces pour réguler l’ébullition.<o:p></o:p>
<o:p> </o:p>
4) Choix du traitement du milieu réactionnel<o:p></o:p>
Une fois la réaction finie il faut isoler le produit :<o:p></o:p>
- extraction avec une ampoule à décanter : il faut deux solvants non miscibles entre eux et de différentes solubilité des espèces chimiques dans les deux solvants.<o:p></o:p>
Si les impuretés sont plus solubles cette méthode permet un lavage de la phase organique.<o:p></o:p>
- le séchage de la phase organique : on utilise le sulfate de magnésium ou le sodium anhydre qui permet d’enlever l’eau de la phase organique.<o:p></o:p>
- l’évaporation du solvant qui tire profit des faibles températures d’ébullition des solvants courants.<o:p></o:p>
- la filtration sépare un solide d’un liquide.<o:p></o:p>
<o:p> </o:p>
5) Choix de la technique de purification<o:p></o:p>
On a un produit brut mais pas pur :<o:p></o:p>
- la distillation sépare les constituants d’un mélange liquide dont les températures d’ébullitions sont différentes.<o:p></o:p>
- la recristallisation permet d’éliminer les impuretés présentes dans un solide en jouant avec les différences de solubilité des impuretés dans un solvant en fonction de la température.<o:p></o:p>
- la chromatographie sur colonnes permet de séparer les constituants. Elle permet de récupérer les constituants en bas de colonne. Le plus soluble est le premier à sortir.<o:p></o:p>
<o:p> </o:p>
6) Choix de la technique d’analyse<o:p></o:p>
- spectre RMN / visible / infrarouge<o:p></o:p>
- chromatographie sur couche mince<o:p></o:p>
- température de fusion et d’ébullition<o:p></o:p>
<o:p> </o:p>
7) Calcul du rendement d’une synthèse<o:p></o:p>
<o:p> </o:p>
nexp est obtenu après purification<o:p> </o:p>
III) Sélectivité en chimie organique<o:p></o:p>
Une molécule polyfonctionnelle est une molécule qui possède plusieurs groupes caractéristiques.<o:p></o:p>
Une réaction non sélective utilise des réactifs chimio sélectifs et / ou des groupes protecteurs.<o:p></o:p>
Quand il n’existe aucun réactif chimio sélectif on utilise des groupements protecteurs.<o:p></o:p>
Les groupements protecteurs doivent :<o:p></o:p>
- réagir de manière sélective avec fonction à protéger<o:p></o:p>
- être stable lors des réactions suivantes<o:p></o:p>
- pouvoir être retirer facilement et de manière sélective<o:p></o:p>
- être peu onéreux et peu toxique<o:p></o:p>
Les étapes de protection et de déprotection doivent avoir lieu avec de très bons rendements.<o:p></o:p>
 votre commentaire
votre commentaire
-
Chapitre 20 - numérisation de l’information<o:p></o:p>
<o:p> </o:p>
<o:p> </o:p>
<o:p> </o:p>
I) Qu’est-ce qu’un signal ?<o:p></o:p>
Un signal est la représentation physique d’une information qui est transportée de la source au destinataire.<o:p></o:p>
<o:p> </o:p>
1) Les signaux analogiques<o:p></o:p>
Ce sont des signaux qui varient de façon continue au cours du temps. Ce sont des tensions.<o:p></o:p>
<o:p> </o:p>
2) Les signaux numériques<o:p></o:p>
Ce sont des signaux qui transportent une information sous forme de nombre.<o:p></o:p>
Le binaire est une succession de bits (0 et 1). <o:p></o:p>
8 bits forment un octet.<o:p></o:p>
<o:p> </o:p>
II) Conversion analogique / numérique<o:p></o:p>
1) L’échantillonnage<o:p></o:p>
On va bloquer la valeur de la tension à intervalle de temps régulier (intervalle point). Il s’accompagne d’une perte de variation entre les échantillonnages.<o:p></o:p>
<o:p> </o:p>
2) Le blocage<o:p></o:p>
Le blocage permet de garder constante la tension échantillonnée pendant l’intervalle de temps séparant deux échantillonnages.<o:p></o:p>
La période d’échantillonnage te est le temps où le signal est bloqué à des valeurs constantes.<o:p></o:p>
<o:p> </o:p>
3) La quantification <o:p></o:p>
La quantification s’accompagne d’une perte d’information sur la tension. Elle est discrétisé par pas ou quantum.<o:p></o:p>
La valeur quantifiée va être associé à une valeur numérique.<o:p></o:p>
<o:p> </o:p>
Lors de la numérisation le temps et la tension sont associés à une couple de valeurs numérique.<o:p></o:p>
<o:p> </o:p>
4) Le codage<o:p></o:p>
Le codage est associé à un binaire.<o:p></o:p>
<o:p> </o:p>
III) Convertisseur analogique / numérique<o:p></o:p>
Il est caractérisé par :<o:p></o:p>
- sa plage d’entrée (amplitude<o:p></o:p>
- sa résolution (nombre de valeurs discrètes qu’il peut produire)<o:p></o:p>
- son pas (la plus petite dimension / tension convertible)<o:p></o:p>
- sont temps de conversion (le temps pour convertir doit être inférieur à la période d’échantillonnage)<o:p></o:p>
<o:p> </o:p>
Chaque cellule photoélectrique est placée en quadrillage.<o:p></o:p>
<o:p> </o:p>
1) Pixellisation<o:p></o:p>
La pixellisation est le fait de convertir une image en pixel (portion de surface élémentaire qui permet d’échantillonner spatialement une image)<o:p></o:p>
La définition d’une image est le nombre de pixel qu’elle contient.<o:p></o:p>
La résolution est le nombre de pixel par unité de longueur (définit en ppp = pixel par pouce).<o:p></o:p>
<o:p> </o:p>
2) Principe du codage d’une image<o:p></o:p>
Chaque cellule du capteur va mesurer l’intensité lumineuse moyenne correspondant à un pixel. Elle est une grandeur analogique. <o:p></o:p>
Elle va être convertit sous forme de tension électrique. Elle va être quantifié, échantillonnée, numérisée.<o:p></o:p>
À chaque valeur de l’intensité lumineuse va être associé à un niveau de gris numériquement.<o:p></o:p>
Par exemple une image possédant deux niveaux de gris chaque pixel ne nécessite alors qu’un seul bit (0 ou 1). L’image sera en noir et blanc.<o:p></o:p>
Si chaque pixel est codé par 4 bits alors il y aura 16 niveaux de gris.<o:p></o:p>
Si chaque pixel est codé par 1 octet (8 bits) alors il y aura 256 niveaux de gris.<o:p></o:p>
<o:p> </o:p>
Dans la mémoire il faudra stocker la valeur de l’intensité et la position du pixel correspondant.<o:p></o:p>
L’image est alors reconstitué par un ordinateur.<o:p></o:p>
<o:p> </o:p>
3) Codage RVB (rouge vert bleu)<o:p></o:p>
Le rouge, le vert et le bleu sont les trois couleurs primaires. <o:p></o:p>
Quand on superpose ces couleurs on obtient les couleurs suivantes.<o:p></o:p>
Avec la variation des trois couleurs, on peut recréer toutes ces couleurs ? Chaque pixel est composé de trois sources lumineuses (rouge/vert/bleu)<o:p></o:p>
Le codage des couleurs possède trois échelles numériques fixant les valeurs des trois couleurs primaires.<o:p></o:p>
Si trois valeurs sont codées de la même manière alors ce sera un niveau de gris.<o:p></o:p>
Si trois valeurs sont codées différemment alors ce sera une couleur.<o:p></o:p>
Chaque échelle est codée sur 8 bits.<o:p></o:p>
<o:p> </o:p>
 votre commentaire
votre commentaire